
Struttura, proprietà, nomenclatura, usi dell'ossido di ferro
UN ossido di ferro È uno dei composti formati tra ferro e ossigeno. Sono caratterizzati dall'essere ionici e cristallini e giacciono sparsi a causa dell'erosione dei loro minerali, costituendo il suolo, la massa vegetale e persino l'interno degli organismi viventi..
È quindi una delle famiglie di composti che predominano nella crosta terrestre. Cosa sono esattamente? Ad oggi sono noti sedici ossidi di ferro, la maggior parte dei quali di origine naturale e altri sintetizzati in condizioni estreme di pressione o temperatura..

Una porzione di ossido ferrico in polvere è mostrata nell'immagine sopra. Il suo caratteristico colore rosso riveste il ferro di vari elementi architettonici in quella che è conosciuta come ruggine. Allo stesso modo, si osserva sui pendii, montagne o suoli, mescolato con molti altri minerali, come la polvere gialla di goethite (α-FeOOH).
Gli ossidi di ferro più conosciuti sono l'ematite (α-FeDueO3) e maghemite (ϒ- FeDueO3), entrambi polimorfi di ossido ferrico; e, non ultimo, magnetite (Fe3O4). Le loro strutture polimorfiche e la loro ampia superficie li rendono materiali interessanti come assorbenti, o per la sintesi di nanoparticelle con ampie applicazioni..
Indice articolo
- 1 Struttura
- 1.1 Polimorfismo
- 1.2 Collegamenti strutturali
- 2 Proprietà
- 3 Nomenclatura
- 3.1 Nomenclatura sistematica
- 3.2 Nomenclatura dei titoli
- 3.3 Nomenclatura tradizionale
- 4 Usi
- 4.1 Nanoparticelle
- 4.2 Pigmenti
- 5 Riferimenti
Struttura
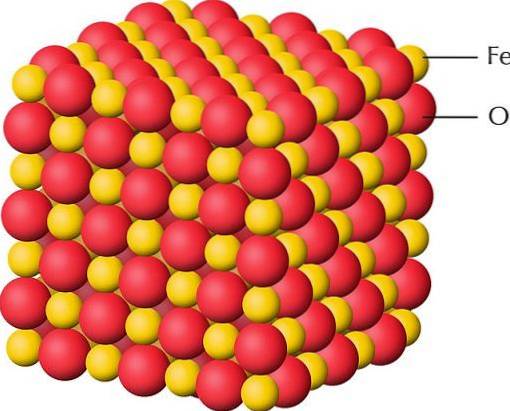
L'immagine in alto è una rappresentazione della struttura cristallina di FeO, uno degli ossidi di ferro in cui il ferro ha una valenza di +2. Le sfere rosse corrispondono agli anioni ODue-, mentre quelli gialli ai cationi FeDue+. Nota anche che ogni fedeDue+ è circondato da sei ODue-, formando un'unità ottaedrica di coordinazione.
Pertanto, la struttura di FeO può essere "sbriciolata" in unità di FeO.6, dove l'atomo centrale è FeDue+. Nel caso di ossidrossidi o idrossidi l'unità ottaedrica è FeO3(OH)3.
In alcune strutture, al posto dell'ottaedro, ci sono unità tetraedriche, FeO4. Per questo motivo, le strutture degli ossidi di ferro sono solitamente rappresentate con ottaedri o tetraedri con centri di ferro..
Le strutture degli ossidi di ferro dipendono dalle condizioni di pressione o temperatura, dal rapporto Fe / O (cioè quanti ossigeni ci sono per ferro e viceversa), e dalla valenza del ferro (+2, +3 e, molto raramente negli ossidi sintetici, +4).
In generale, gli anioni voluminosi ODue- sono fogli allineati formanti i cui fori ospitano i cationi FeDue+ o Fede3+. Quindi, ci sono ossidi (come la magnetite) che hanno ferri con entrambe le valenze.
Polimorfismo
Gli ossidi di ferro presentano polimorfismo, cioè strutture differenti o disposizioni cristalline per lo stesso composto. Ossido ferrico, FeDueO3, ha fino a quattro possibili polimorfi. Ematite, α-FeDueO3, è il più stabile di tutti; seguito dal maghemita, ϒ- FedeDueO3, e dal sintetico β-FeDueO3 e ε- FeDueO3.
Hanno tutti i propri tipi di strutture e sistemi cristallini. Tuttavia, il rapporto 2: 3 rimane costante, quindi ci sono tre anioni ODue- per ogni due cationi Fe3+. La differenza sta nel modo in cui si trovano le unità ottaedriche FeO.6 nello spazio e come vi riunite.
Collegamenti strutturali

Unità ottaedriche FeO6 può essere visualizzato utilizzando l'immagine sopra. Agli angoli dell'ottaedro c'è la ODue-, mentre al centro la FedeDue+ o Fede3+(nel caso di FeDueO3). Il modo in cui questi ottaedri sono disposti nello spazio rivela la struttura dell'ossido.
Tuttavia, influenzano anche il modo in cui sono collegati. Ad esempio, due ottaedri possono essere uniti toccando due dei loro vertici, che è rappresentato da un ponte di ossigeno: Fe-O-Fe. Allo stesso modo, gli ottaedri possono unirsi attraverso i loro bordi (adiacenti l'uno all'altro). Sarebbe quindi rappresentato con due ponti di ossigeno: Fe- (O)Due-Fede.
Infine, gli ottaedri possono interagire attraverso i loro volti. Quindi, la rappresentazione sarebbe ora con tre ponti di ossigeno: Fe- (O)3-Fe. Il modo in cui gli ottaedri sono collegati, varierebbe le distanze internucleari Fe-Fe e, quindi, le proprietà fisiche dell'ossido.
Proprietà
Un ossido di ferro è un composto con proprietà magnetiche. Questi possono essere anti, ferrosi o ferrimagnetici e dipendono dalle valenze del Fe e da come i cationi interagiscono nel solido..
Poiché le strutture dei solidi sono molto varie, lo sono anche le loro proprietà fisiche e chimiche.
Ad esempio, i polimorfi e gli idrati di FeDueO3 hanno diversi valori di punti di fusione (che variano tra 1200 e 1600ºC) e densità. Tuttavia, hanno in comune la bassa solubilità dovuta al Fe3+, della stessa massa molecolare, sono di colore marrone e si dissolvono con parsimonia in soluzioni acide.
Nomenclatura
La IUPAC stabilisce tre modi per denominare un ossido di ferro. Tutti e tre sono molto utili, sebbene per ossidi complessi (come Fe7O9) la sistematica governa sulle altre per la sua semplicità.
Nomenclatura sistematica
Vengono presi in considerazione i numeri di ossigeno e ferro nominandoli con i prefissi di numerazione greca mono-, di-, tri-, ecc. Secondo questa nomenclatura il FeDueO3 è chiamato: triossido di ha datoferro. E per la fede7O9 il suo nome sarebbe: ossido di ferro non epta.
Nomenclatura azionaria
Questo considera la valenza del ferro. Se si tratta di FaithDue+, l'ossido di ferro è scritto ..., e la sua valenza con numeri romani racchiusi tra parentesi. Per la fedeDueO3 il suo nome è: ossido di ferro (III).
Nota che Fe3+ può essere determinato da somme algebriche. Se l'ODue- Ha due cariche negative e ce ne sono tre, si sommano a -6. Per neutralizzare questo -6, è necessario +6, ma ci sono due Fe, quindi devono essere divisi per due, + 6/2 = +3:
2X (valenza metallica) + 3 (-2) = 0
Semplicemente risolvendo per X, si ottiene la valenza di Fe nell'ossido. Ma se X non è un numero intero (come nel caso di quasi tutti gli ossidi rimanenti), allora c'è una miscela di FeDue+ e la fede3+.
Nomenclatura tradizionale
Il suffisso -ico è dato al prefisso ferr- quando Fe ha valenza +3 e -oso quando la sua valenza è 2+. Pertanto, il FeDueO3 si chiama: ossido ferrico.
Applicazioni
Nanoparticelle
Gli ossidi di ferro hanno in comune un'elevata energia di cristallizzazione, che permette di creare cristalli molto piccoli ma con una grande area superficiale..
Per questo motivo sono di grande interesse nel campo delle nanotecnologie, dove progettano e sintetizzano nanoparticelle di ossido (NP) per scopi specifici:
-Come catalizzatori.
-Come riserva di farmaci o geni all'interno del corpo
-Nella progettazione di superfici sensoriali per diversi tipi di biomolecole: proteine, zuccheri, grassi
-Per memorizzare dati magnetici
Pigmenti
Poiché alcuni ossidi sono molto stabili, possono essere utilizzati per tingere tessuti o dare colori brillanti alle superfici di qualsiasi materiale. Dai mosaici sui pavimenti; vernici rosse, gialle e arancioni (anche verdi); ceramica, plastica, pelle e persino opere architettoniche.
Riferimenti
- Amministratori del Dartmouth College. (18 marzo 2004). Stechiometria degli ossidi di ferro. Tratto da: dartmouth.edu
- Ryosuke Sinmyo et al. (2016, 8 settembre). Scoperta di Fe7O9: un nuovo ossido di ferro con una complessa struttura monoclina. Estratto da: nature.com
- M. Cornell, U. Schwertmann. Gli ossidi di ferro: struttura, proprietà, reazioni, occorrenze e usi. [PDF]. WILEY-VCH. Tratto da: epsc511.wustl.edu
- Alice Bu. (2018). Nanoparticelle di ossido di ferro, caratteristiche e applicazioni. Tratto da: sigmaaldrich.com
- Ali, A., Zafar, H., Zia, M., ul Haq, I., Phull, A. R., Ali, J. S. e Hussain, A. (2016). Sintesi, caratterizzazione, applicazioni e sfide delle nanoparticelle di ossido di ferro. Nanotecnologia, scienza e applicazioni, 9, 49-67. http://doi.org/10.2147/NSA.S99986
- Pigmenti Golchha. (2009). Ossidi di ferro: applicazioni. Tratto da: golchhapigments.com
- Formulazione chimica. (2018). Ossido di ferro (II). Tratto da: formulacionquimica.com
- Wikipedia. (2018). Ossido di ferro (III). Tratto da: https://en.wikipedia.org/wiki/Iron(III)_oxide



Nessun utente ha ancora commentato questo articolo.