
Struttura, proprietà, usi, produzione del solfato di sodio (Na2SO4)

Il solfato di sodio è un sale inorganico la cui formula chimica è NaDueSW4. È costituito da un solido bianco, presente in tre forme: anidro, eptaidrato (scarsamente disponibile) e decaidrato (noto come sale di Glaubert); quest'ultima è la forma più abbondante di solfato di sodio.
Sodio solfato decaidrato, NaDueSW410HDueOppure fu scoperto nel 1625 da Glaubert nell'acqua di una sorgente, che lo chiamò sal mirabilis (sale miracoloso) per le sue proprietà medicinali.

Il solfato di sodio ha numerose applicazioni nell'industria tessile e della carta, nonché nella produzione di vetro. I suoi usi sono estesi alle applicazioni termiche, che includono la fornitura di calore ambientale e il raffreddamento del laptop..
Il solfato di sodio è un composto a bassa tossicità e le sue azioni dannose sono principalmente meccaniche e non chimiche. Per ragioni cristallografiche questo sale, come la sua controparte di potassio, KDueSW4, presenta strutture reticolari e polimorfiche.
Indice articolo
- 1 Struttura
- 1.1 Sale anidro
- 1.2 Sale decaidrato
- 2 Proprietà
- 2.1 Nomi
- 2.2 Massa molare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Aroma
- 2.6 Densità
- 2.7 Punto di fusione
- 2.8 Punto di ebollizione
- 2.9 Solubilità in acqua
- 2.10 Indice di rifrazione
- 2.11 Stabilità
- 2.12 Decomposizione
- 2,13 pH
- 2.14 Reattività
- 3 usi
- 3.1 Industria della carta
- 3.2 Detersivi
- 3.3 Bicchieri
- 3.4 Industria tessile
- 3.5 Medicina
- 3.6 Agente essiccante
- 3.7 Materia prima
- 4 Ottenimento
- 4.1 Estrazione mineraria
- 4.2 Produzione chimica
- 5 Rischi
- 6 Riferimenti
Struttura
Sale anidro
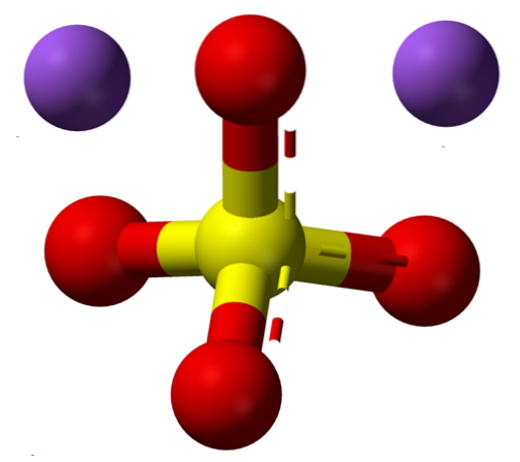
La formula NaDueSW4 indica subito che gli ioni Na nei cristalli di sale+ E così4Due- sono in un rapporto 1: 2; cioè per ogni due Na cationi+ c'è un anione SO4Due- interagendo con loro tramite attrazione elettrostatica (immagine in alto).
Ovviamente questo vale per NaDueSW4 anidro, senza molecole d'acqua coordinate con il sodio all'interno dei cristalli.
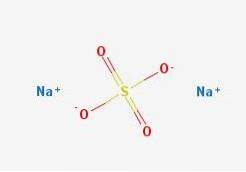
Nonostante sia un sale apparentemente semplice, la sua descrizione è strutturalmente complessa. Poi unDueSW4 presenta polimorfismo, con fino a cinque fasi cristalline: I, II, III, IV e V, le cui temperature di transizione sono rispettivamente di 180, 200, 228, 235 e 883 ºC.
Nonostante non ci siano riferimenti per certificarlo, il NaDueSW4Devo essere quello con una struttura cristallina esagonale, più densa rispetto al Na ortorombicoDueSW4III, nei cui cristalli Na+ forma tetraedri (NaO4) e ottaedri (NaO6) coordinazione; cioè, può essere circondato da quattro o sei anioni SO4Due-.
Sale decaidrato
Nel frattempo, la struttura cristallina monoclina del suo idrato più importante, NaDueSW410HDueOppure è più semplice. In esso, sono praticamente le molecole d'acqua che interagiscono o si coordinano con Na+ nell'ottaedro Na (H.DueO)6+, con il SO4Due- fornendo solo una stabilità sufficiente al cristallo in modo che esista nella fase solida.
Tuttavia, il suo punto di fusione (32,38 ºC) molto inferiore a quello del sale anidro (884 ºC) mostra come le molecole d'acqua ei loro legami idrogeno indeboliscano le interazioni ioniche più forti nel NaDueSW4.
Proprietà
Nomi
-Solfato di sodio (IUPAC)
-Sale di Glauber (decaidrato)
-Sale miracoloso (decaidrato)
-Solfato di disodio.
Massa molare
142,04 g / mol (anidro)
322,20 g / mol (decaidrato)
Aspetto fisico
Solido cristallino igroscopico bianco
Odore
Gabinetto
Gusto
Amaro e salato
Densità
2.664 g / cm3 (anidro)
1.464 g / cm3 (decaidrato)
Nota come le molecole d'acqua all'interno dei cristalli li fanno espandere e, quindi, diminuire la loro densità..
Punto di fusione
884 ºC (anidro)
32,38 ºC (decaidrato)
Punto di ebollizione
1.429 ºC (anidro)
Solubilità dell'acqua
4,76 g / 100 ml (0 ºC)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Tutti i valori di solubilità corrispondono al sale anidro, che è abbastanza solubile in acqua a tutte le temperature..
La solubilità aumenta bruscamente tra 0 ° C e 38,34 ° C, osservando che in questo intervallo di temperatura la solubilità aumenta più di 10 volte. Tuttavia, a partire da 32,38 ºC, la solubilità è indipendente dalla temperatura..
Succede che ad una temperatura di 32,8 ºC, il solfato di sodio decaidrato si dissolva nella propria acqua cristallina. Si raggiunge così un equilibrio tra il sale decaidrato, il sale anidro e la soluzione satura di solfato di sodio..
Finché viene mantenuta la condizione trifase, la temperatura rimarrà costante, il che consente di calibrare la temperatura dei termometri.
D'altra parte, le solubilità per il sale eptaidrato sono:
19,5 g / 100 ml (0 ºC)
44,0 g / 100 ml (20 ° C)
Si noti che a 20 ° C il sale eptaidrato è tre volte più solubile di quello anidro..
Indice di rifrazione
1.468 (anidro)
1.394 (decaidrato)
Stabilità
Stabile nelle condizioni di conservazione consigliate. Incompatibile con acidi e basi forti, alluminio e magnesio.
Decomposizione
Quando riscaldato fino alla decomposizione emette un fumo tossico di ossido di zolfo e ossido di sodio..
pH
Una soluzione acquosa al 5% ha un pH di 7.
Reattività
Il solfato di sodio si dissocia in soluzione acquosa in 2 Na+ E così4Due-, che consente allo ione solfato di combinarsi con il BaDue+ precipitare solfato di bario. In pratica aiuta a spostare gli ioni bario dai campioni d'acqua.
Il solfato di sodio viene convertito in solfuro di sodio reagendo a temperature elevate con il carbone:
N / ADueSW4 + 2 C => NaDueS + 2 CODue
Sale di Glaubert, NaSO4.10HDueOppure reagisce con il carbonato di potassio per produrre carbonato di sodio.
Applicazioni
Industria della carta
Il solfato di sodio viene utilizzato nella produzione di pasta di carta. Viene utilizzato nella produzione della carta Kraft, che non contiene lignina o è sottoposta al processo di sbiancamento, che le conferisce una grande resistenza. Inoltre, viene utilizzato nella produzione di cartone.
Detersivi
Utilizzato come materiale di riempimento per detergenti domestici sintetici, viene aggiunto al detergente per ridurre la tensione superficiale.
Bicchieri
Viene utilizzato nella lavorazione del vetro per ridurre o eliminare la presenza di piccole bolle d'aria nel vetro fuso. Inoltre, elimina la formazione di scorie durante il processo di raffinazione del vetro fuso.
Industria tessile
Il solfato di sodio è usato come mordente, poiché facilita l'interazione dei coloranti con le fibre dei tessuti. Il solfato di sodio decaidrato viene utilizzato nel test della tintura.
Inoltre, il solfato di sodio viene utilizzato come diluente colorante e agente ausiliario per la stampa a colori; come coloranti diretti, coloranti allo zolfo e altri agenti che promuovono la colorazione del cotone. È anche usato come agente ritardante per coloranti di seta diretti.
Medicinale
Il solfato di sodio decaidrato viene utilizzato come lassativo, poiché è scarsamente assorbito a livello intestinale, e quindi rimane nel lume dell'intestino provocando un aumento di volume. Questo stimola l'aumento delle contrazioni peristaltiche che inducono l'espulsione del contenuto intestinale..
Il solfato di sodio è un antidoto per controllare l'avvelenamento da bario e sale da piombo. Il sale di Glaubert è efficace per l'eliminazione di alcuni farmaci ingeriti eccessivamente; ad esempio, paracetamolo (acetoaminofene).
Inoltre, viene utilizzato per fornire elettroliti carenti presenti nelle soluzioni isoosmotiche..
Agente essiccante
Il solfato di sodio, essendo un reagente inerte, viene utilizzato per rimuovere l'acqua da soluzioni di composti organici..
Materiale grezzo
Il solfato di sodio viene utilizzato come materia prima per la produzione di numerose sostanze, tra cui: solfuro di sodio, carbonato di sodio e solfato di ammonio.
Ottenere
Il solfato di sodio si ottiene per estrazione mineraria e per reazioni chimiche.
Estrazione mineraria
Ci sono tre minerali o minerali che vengono sfruttati con resa commerciale: la tenardite (NaDueSW4), la mirabilite (NaDueSW410HDueO) e glaubarite (NaDueSW4·Astuccio4).
In Spagna, i depositi di tenardite e mirabilite sono sfruttati dall'estrazione sotterranea di gallerie e pilastri. Nel frattempo, la glauberite si ottiene all'aperto, per mezzo di grandi zattere che vengono adagiate sul giacimento minerario.
Il terreno viene preparato con sabbiatura a bassa intensità per produrre una porosità che consente la lisciviazione del solfato di sodio. La fase di produzione avviene con l'irrigazione a pioggia con acqua dolce della glauberite, la cui lisciviazione si diffonde verso il basso..
La salamoia di solfato di sodio viene raccolta, lasciando il residuo di solfato di calcio come riempimento..
Produzione chimica
Il solfato di sodio si ottiene durante la produzione di acido cloridrico mediante due processi: il processo di Mannheim e il processo Hardgreaves.
Processo di Mannheim
Viene eseguito in grandi forni in acciaio e con una piattaforma di reazione in acciaio di 6 m. La reazione avviene tra cloruro di sodio e acido solforico:
2 NaCl + HDueSW4 => 2 HCl + NaDueSW4
Processo hardgreaves
Implica la reazione di cloruro di sodio, ossido di zolfo, ossigeno e acqua:
4 NaCl + 2 SODue + ODue + 2 hDueO => 4 HCl + NaDueSW4
Altri
Il solfato di sodio viene prodotto nella reazione di neutralizzazione tra idrossido di sodio e acido solforico:
2 NaOH + HDueSW4 => NaDueSW4 + HDueO
Il solfato di sodio è un sottoprodotto della produzione di numerosi composti. Viene estratto dai rifiuti liquidi scaricati durante la produzione di viscosa e cellophane. Anche nella produzione di bicromato di sodio, fenoli, acido borico e carbammato di litio.
Rischi
Il solfato di sodio è considerato un composto a bassa tossicità. Tuttavia, potrebbe causare danni alla persona che lo utilizza in modo improprio..
Ad esempio, può causare irritazione agli occhi, arrossamento e dolore al contatto. Sulla pelle può provocare irritazioni e allergie in alcune persone. La sua ingestione può provocare irritazione del tratto digerente con nausea, vomito e diarrea. Infine, la sua inalazione produce irritazione alle vie respiratorie.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Solfato di sodio. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Solfato di sodio. Database PubChem. CID = 24436. Estratto da: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). La struttura cristallina di NaDueSW4III. Recupero da: rruff-2.geo.arizona.edu
- Glauberite-Thenardite (solfato di sodio). [PDF]. Estratto da: igme.es



Nessun utente ha ancora commentato questo articolo.