
Struttura, proprietà, usi, rischi dell'ossido di bario (BaO)

Il ossido di bario È un solido inorganico formato da un atomo di bario (Ba) e un atomo di ossigeno (O). La sua formula chimica è BaO. È un solido cristallino bianco ed è igroscopico, cioè assorbe l'umidità dall'aria, ma così facendo reagisce con essa..
La rapida reazione dell'ossido di bario con l'acqua lo rende utilizzato nei laboratori di analisi chimiche per essiccare, cioè rimuovere l'acqua dai solventi organici, che sono composti liquidi che servono a sciogliere altre sostanze..

BaO si comporta come una base forte, quindi reagisce con molti tipi di acidi. Ad esempio reagisce facilmente con l'anidride carbonica CODue dall'aria per formare il carbonato di bario BaCO3.
Viene utilizzato nella produzione di polimeri per cavi di alimentazione e come ingrediente per le resine per sigillare i fori nei denti che sono stati polimerizzati.
L'ossido di bario (BaO) è utilizzato anche nell'industria ceramica, sia per rivestirlo con smalto che per produrlo. Viene anche utilizzato nelle miscele cementizie per aumentare la resistenza alla compressione del prodotto finale..
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà fisiche
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Densità
- 3.6 Solubilità
- 4 Proprietà chimiche
- 5 Rischi
- 6 Ottenimento
- 7 Usi
- 7.1 Come essiccante per solventi organici
- 7.2 Nelle lampade a scarica
- 7.3 Nella produzione di ceramica
- 7.4 Nella preparazione di miscele cementizie
- 7.5 In varie applicazioni
- 8 Riferimenti
Struttura
L'ossido di bario BaO è costituito da un cationeDue+ e un anione dell'ossigeno ODue-.
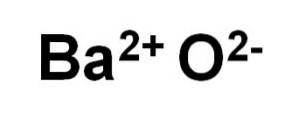
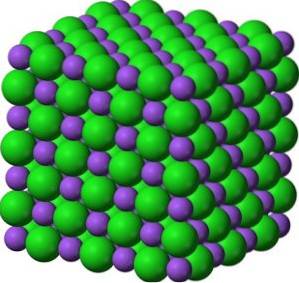
Nei suoi cristalli, BaO forma reti ioniche cubiche (a forma di cubo) del tipo cloruro di sodio.
La configurazione elettronica dello ione bario è: [Xe] 6s0 poiché ha perso i due elettroni del guscio 6s. Questa configurazione è molto stabile.
Nomenclatura
-Ossido di bario
-Monossido di bario
Proprietà fisiche
Stato fisico
Solido cristallino bianco-giallastro.
Peso molecolare
153,33 g / mol
Punto di fusione
1923 ºC
Punto di ebollizione
Circa 2000 ºC.
Densità
5,72 g / cm3
Solubilità
Leggermente solubile in acqua: 3,8 g / 100 mL a 20 ºC.
Proprietà chimiche
L'ossido di bario BaO reagisce rapidamente con l'acqua, emettendo calore e formando una soluzione corrosiva di idrossido di bario Ba (OH)Due, che è l'idrossido più solubile tra gli idrossidi di metalli alcalino terrosi.
BaO + HDueO → Ba (OH)Due
BaO è una base forte. Reagisce esotermicamente (cioè con l'evoluzione del calore) con tutti i tipi di acidi.
Con CODue BaO reagisce per formare il carbonato di bario BaCO3.
BaO + CODue → BaCO3
BaO è igroscopico, quindi se lasciato esposto all'ambiente si unisce poco a poco con l'umidità dell'aria formando Ba (OH)Due che si combina con l'anidride carbonica CODue dall'aria per dare BaCO carbonato di bario3.
Quando il monossido di bario BaO viene riscaldato in presenza di aria, si combina con l'ossigeno per formare il perossido di bario BaODue. La reazione è reversibile.
2 BaO + ODue ⇔ 2 BaODue
In presenza di acqua può reagire con alluminio Al o zinco Zn, formando gli ossidi o idrossidi di detti metalli e generando idrogeno gassoso HDue.
Può iniziare la polimerizzazione di composti organici polimerizzabili, come gli epossidi.
Rischi
Può essere tossico se ingerito. Non dovrebbe entrare in contatto con la pelle. È irritante per gli occhi, la pelle e le vie respiratorie. Può essere dannoso per il sistema nervoso. È in grado di causare bassi livelli di potassio, con conseguenti disturbi cardiaci e muscolari.
Ottenere
L'ossido di bario BaO può essere ottenuto riscaldando il carbonato di bario BaCO3 con carbone. Si forma BaO e viene rilasciato monossido di carbonio CO.
Bacco3 + C → BaO + 2 CO ↑
Applicazioni
Come essiccante per solventi organici
Grazie alla sua facilità di reazione con l'acqua, BaO è stato utilizzato dalla metà del secolo scorso come essiccante per benzina e solventi organici basici o neutri..
BaO è molto attivo nell'essiccazione attorno ad esso, assorbe l'umidità molto rapidamente, con evoluzione di un bel po 'di calore, formando idrossido di bario Ba (OH)Due che è stabile fino a circa 1000 ºC. Per questo motivo BaO può essere utilizzato ad alte temperature..
Possiede inoltre un'elevata capacità di assorbimento dell'acqua. Per ogni molecola di BaO, è possibile assorbire una dell'acqua e il Ba (OH)Due risultante può anche assorbire una certa quantità di acqua.
È adatto per laboratori di chimica analitica. Non appiccicoso.
Può essere utilizzato negli essiccatori, che sono grandi contenitori di vetro con coperchio dove l'ambiente interno viene mantenuto asciutto. BaO mantiene asciutta l'atmosfera in miniatura dell'essiccatore.

Questi essiccatori vengono utilizzati per posizionare sostanze o reagenti e quindi impedire loro di assorbire acqua dall'ambiente.
Viene anche utilizzato per essiccare gas basici come l'ammoniaca NH.3.
Nelle lampade a scarica
BaO è posto sugli elettrodi delle lampade a scarica come materiale che emette elettroni.
Le lampade a scarica sono costituite da un tubo di vetro, quarzo o altro materiale idoneo, contengono un gas inerte e nella maggior parte dei casi un vapore metallico. Il vapore metallico può essere sodio o mercurio.

Le scariche elettriche si verificano all'interno del tubo perché ha un elettrodo positivo e uno negativo.
Il BaO è posto sugli elettrodi della lampada. Gli elettroni che emette entrano in collisione con gli atomi del vapore del metallo e trasmettono loro energia..
Quando una corrente elettrica passa attraverso questo gas o vapore, viene prodotta luce visibile o radiazione ultravioletta (UV)..
Nella produzione di ceramiche
BaO è utilizzato nelle composizioni di rivestimento in smalto ceramico.

Tuttavia, è stato testato anche come additivo nella preparazione della vetroceramica.
BaO migliora efficacemente le caratteristiche meccaniche e la resistenza chimica di questo tipo di ceramica. Ha una forte influenza sulle proprietà termiche e sulla composizione della fase cristallina dei materiali ottenuti..
Nella preparazione di miscele cementizie
BaO è stato testato come componente del cemento fosfoalluminato.
Questo tipo di cemento è utile in ambienti marini, poiché non ha la stessa tendenza ad idratarsi degli altri tipi di cemento, quindi non soffre di formazione di pori o dilatazioni..
Tuttavia, i cementi fosfoalluminosi devono essere rafforzati nelle loro prestazioni meccaniche per resistere alle correnti marine e ai colpi di pezzi di ghiaccio galleggianti presenti nell'oceano..
L'aggiunta di BaO al cemento fosfoalluminoso modifica la struttura minerale di detto materiale, migliora la struttura dei pori e aumenta notevolmente la resistenza a compressione della pasta cementizia..
In altre parole, BaO migliora la resistenza alla compressione di questo tipo di cemento..

In varie applicazioni
È usato come ingrediente per fornire opacità nelle resine dentali per il riempimento di buchi nei denti, eseguito dai dentisti.
Viene anche utilizzato come agente nucleante per la preparazione di polimeri di polivinilidene fluoruro utilizzati per isolare i cavi di alimentazione..
Riferimenti
- Partyka, J. et al. (2016). Effetto dell'aggiunta di BaO sulla sinterizzazione di materiali in vetroceramica da SiODue-AlDueO3-N / ADueVA BENEDueSistema O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Recuperato da link.springer.com.
- Zhang, P. et al. (2019). Effetto del BaO sulla struttura minerale e sul comportamento di idratazione del cemento fosfoalluminato. J Therm Anal Calorim (2019) 136: 2319. Recuperato da link.springer.com.
- NOI. Biblioteca nazionale di medicina. (2019). Ossido di bario. Recupero da pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Illuminazione. Principio. Nel libro di riferimento dell'ingegnere elettrico (sedicesima edizione). Recupero da sciencedirect.com.
- Ebnesajjad, S. (2003). Schiume fluoropolimeriche. PVDF schiumogeno. In fluoroplastica processabile allo stato fuso. Recupero da sciencedirect.com.
- Booth, H.S. e McIntyre, L.H. (1930). Ossido di bario come essiccante. Ind. Ing. Chem. Anal. Ed. 1930, 2, 1, 12-15. Recuperato da pubs.acs.org.



Nessun utente ha ancora commentato questo articolo.