
Voltammetria in cosa consiste, tipologie e applicazioni
Il voltammetria È una tecnica elettroanalitica che determina le informazioni di una specie chimica o di un analita dalle correnti elettriche generate dalla variazione di un potenziale applicato. Cioè, il potenziale applicato E (V) e il tempo (t) sono le variabili indipendenti; mentre la corrente (A), la variabile dipendente.
Le specie chimiche devono essere normalmente elettroattive. Cosa significa? Significa che deve perdere (ossidarsi) o guadagnare (ridurre) elettroni. Affinché la reazione abbia inizio, l'elettrodo di lavoro deve fornire il potenziale necessario teoricamente determinato dall'equazione di Nernst.
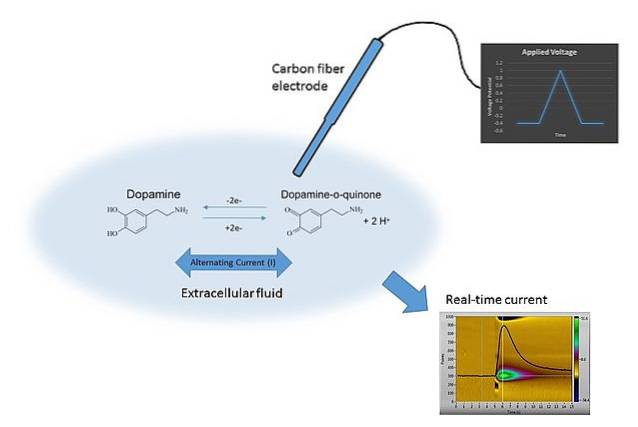
Un esempio di voltammetria può essere visto nell'immagine sopra. L'elettrodo nell'immagine è costituito da fibre di carbonio, che è immerso nel mezzo di dissoluzione. La dopamina non si ossida, formando due gruppi carbonilici C = O (lato destro dell'equazione chimica) a meno che non venga applicato il potenziale appropriato.
Ciò si ottiene scansionando E con valori diversi, limitati da molti fattori come la soluzione, gli ioni presenti, lo stesso elettrodo e la dopamina..
Variando E nel tempo, si ottengono due grafici: il primo E v t (il triangolo blu), e il secondo, la risposta C vs t (giallo). Le sue forme sono caratteristiche per determinare la dopamina nelle condizioni dell'esperimento..
Indice articolo
- 1 Cos'è la voltammetria??
- 1.1 Onda voltammetrica
- 1.2 Strumentazione
- 2 tipi
- 2.1 Voltammetria a impulsi
- 2.2 Voltammetria di ridissoluzione
- 3 Applicazioni
- 4 Riferimenti
Cos'è la voltammetria?
La voltammetria è stata sviluppata grazie all'invenzione della tecnica della polarografia da parte del vincitore del Premio Nobel per la chimica nel 1922, Jaroslav Heyrovsky. In esso, l'elettrodo della goccia di mercurio (EGM) viene costantemente rinnovato e polarizzato.
Le carenze analitiche di questo metodo a quel tempo furono risolte con l'uso e la progettazione di altri microelettrodi. Questi variano enormemente nel materiale, dal carbonio, metalli nobili, diamanti e polimeri, al loro design, dischi, cilindri, fogli; e anche nel modo in cui interagiscono con la soluzione: stazionarie o rotanti.
Tutti questi dettagli hanno lo scopo di favorire la polarizzazione dell'elettrodo, che provoca un decadimento della corrente registrata noto come corrente limite (i1). Questo è proporzionale alla concentrazione dell'analita e metà della potenza E (E1/2) per raggiungere la metà di detta corrente (i1/2) è caratteristico della specie.
Quindi, determinando i valori di E1/2 sulla curva dove viene chiamata la corrente ottenuta con la variazione di E voltamperogramma, la presenza di un analita può essere identificata. Cioè, ogni analita, date le condizioni dell'esperimento, avrà il proprio valore di E1/2.
Onda voltammetrica
In voltammetria lavori con molti grafici. La prima è la curva E vs t, che permette di avere un follow-up delle differenze di potenziale applicate in funzione del tempo.
Ma allo stesso tempo, il circuito elettrico registra i valori C prodotti dall'analita perdendo o guadagnando elettroni in prossimità dell'elettrodo..
Poiché l'elettrodo è polarizzato, meno analita può diffondersi dall'interno della soluzione in esso. Ad esempio, se l'elettrodo è caricato positivamente, la specie X- ne saranno attratti e vi si avvicineranno per mera attrazione elettrostatica.
Ma X- Non sei solo: ci sono altri ioni presenti nel tuo ambiente. Alcuni cationi M+ possono intralciare l'elettrodo racchiudendolo in "grappoli" di cariche positive; e allo stesso modo, N anioni- può rimanere impigliato intorno all'elettrodo e impedire X- Sono arrivato a lui.
La somma di questi fenomeni fisici causa la perdita di corrente, e questo si osserva nella curva C vs E e la sua forma è simile a quella di una S, chiamata forma sigmoidea. Questa curva è nota come onda voltammetrica..
Strumentazione
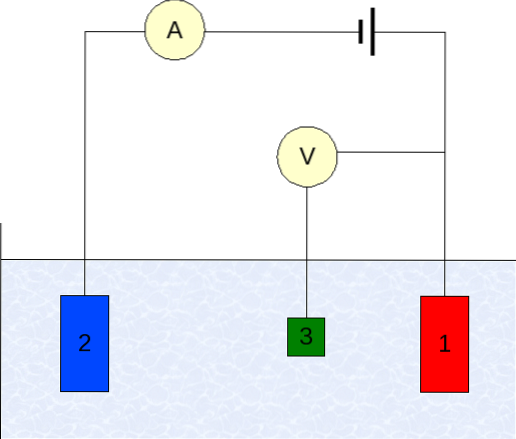
La strumentazione della voltammetria varia a seconda dell'analita, del solvente, del tipo di elettrodo e dell'applicazione. Ma la stragrande maggioranza di essi si basa su un sistema composto da tre elettrodi: uno da lavoro (1), ausiliario (2) e quello di riferimento (3)..
L'elettrodo di riferimento principale utilizzato è l'elettrodo al calomelano (ECS). Questo, insieme all'elettrodo di lavoro, consente di stabilire una differenza di potenziale ΔE, poiché il potenziale dell'elettrodo di riferimento rimane costante durante le misurazioni..
L'elettrodo ausiliario, invece, ha il compito di controllare la carica che passa all'elettrodo di lavoro, al fine di mantenerlo entro valori E accettabili. La variabile indipendente, la differenza di potenziale applicata, è quella ottenuta sommando i potenziali degli elettrodi di lavoro e di riferimento..
Tipi

L'immagine sopra mostra un grafico E vs t, chiamato anche onda potenziale per una voltammetria a scansione lineare..
Si può vedere che col passare del tempo, il potenziale aumenta. A sua volta, questa scansione genera una curva di risposta o voltamperogramma C vs E la cui forma sarà sigmoidea. Arriverà un punto in cui non importa quanto E aumenta, non ci sarà alcun aumento della corrente.
Altri tipi di voltammetria possono essere dedotti da questo grafico. Come? Modifica dell'onda potenziale E vs t attraverso impulsi potenziali improvvisi che seguono determinati schemi. Ogni modello è associato a un tipo di voltammetria e comprende la propria teoria e condizioni sperimentali..
Voltammetria a impulsi
In questo tipo di voltammetria, miscele di due o più analiti i cui valori E possono essere analizzati1/2 sono molto vicini gli uni agli altri. Quindi, un analita con E1/2 di 0,04 V possono essere identificati in compagnia di un altro con una E1/2 di 0,05 V. Nella voltammetria a scansione lineare, la differenza deve essere maggiore di 0,2 V..
Pertanto, vi sono una maggiore sensibilità e limiti di rilevamento inferiori; cioè gli analiti possono essere determinati a concentrazioni molto basse.
Le onde di potenziali possono avere schemi simili a scale, scale inclinate e triangoli. Quest'ultima corrisponde alla voltammetria ciclica (CV per il suo acronimo in inglese, prima immagine).
In CV un potenziale E viene applicato in una direzione, positiva o negativa, e poi, ad un certo valore di E al tempo t, lo stesso potenziale viene applicato di nuovo ma nella direzione opposta. Nello studio dei voltamperogrammi generati, i massimi rivelano la presenza di intermediari in una reazione chimica.
Voltammetria di ridissoluzione
Questo può essere di tipo anodico o catodico. Consiste nell'elettrodeposizione dell'analita su un elettrodo di mercurio. Se l'analita è uno ione metallico (come CdDue+), si formerà un amalgama; e se è un anione, (come MoO4Due-) un sale di mercurio insolubile.
Quindi, vengono applicati impulsi di potenziali per determinare la concentrazione e l'identità delle specie elettrodepositate. Così, l'amalgama viene ridisciolto, come i sali di mercurio.
Applicazioni
-La voltammetria di ridissoluzione anodica viene utilizzata per determinare la concentrazione dei metalli disciolti nel fluido.
-Permette di studiare la cinetica dei processi redox o adsorbimento, soprattutto quando gli elettrodi vengono modificati per rilevare uno specifico analita.
-La sua base teorica è stata utilizzata per la produzione di biosensori. Con questi è possibile determinare la presenza e la concentrazione di molecole biologiche, proteine, grassi, zuccheri, ecc..
-Infine, rileva la partecipazione degli intermediari ai meccanismi di reazione.
Riferimenti
- González M. (22 novembre 2010). Voltammetria. Estratto da: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Analisi elettrochimica. Journal of Biological Diagnosis, 51 (1), 18-27. Recupero da scielo.isciii.es
- Chimica e scienza. (18 luglio 2011). Voltammetria. Estratto da: laquimicaylaciencia.blogspot.com
- Quiroga A. (16 febbraio 2017). Voltammetria ciclica. Recupero da: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Tecniche voltammetriche. [PDF]. Tufts University. Estratto da: brown.edu
- Day R. e Underwood A. Chimica analitica quantitativa (quinto ed.). PEARSON Prentice Hall.



Nessun utente ha ancora commentato questo articolo.