
Configurazione e composti di valenze di azoto

Il valenze di azoto Vanno da -3, come nell'ammoniaca e nelle ammine, a +5 come nell'acido nitrico (Tyagi, 2009). Questo elemento non espande le valenze come gli altri.
L'atomo di azoto è un elemento chimico con numero atomico 7 e il primo elemento del gruppo 15 (ex VA) della tavola periodica. Il gruppo è composto da azoto (N), fosforo (P), arsenico (As), antimonio (Sb), bismuto (Bi) e moscovio (Mc).

Gli elementi condividono alcune somiglianze generali nel comportamento chimico, sebbene siano chiaramente differenziati chimicamente l'uno dall'altro. Queste somiglianze riflettono caratteristiche comuni delle strutture elettroniche dei loro atomi (Sanderson, 2016).
L'azoto è presente in quasi tutte le proteine e svolge un ruolo importante sia nelle applicazioni biochimiche che industriali. L'azoto forma legami forti grazie alla sua capacità di formare un triplo legame con un altro atomo di azoto e altri elementi..
Pertanto, c'è una grande quantità di energia nei composti dell'azoto. Prima di 100 anni fa, si sapeva poco dell'azoto. Ora, l'azoto è comunemente usato per conservare il cibo e come fertilizzante (Wandell, 2016).
Configurazione elettronica e valenze
In un atomo, gli elettroni riempiono i diversi livelli in base alle loro energie. I primi elettroni riempiono i livelli di energia più bassi e poi si spostano a un livello di energia più alto.
Il livello di energia più esterno in un atomo è noto come guscio di valenza e gli elettroni posti in questo guscio sono noti come elettroni di valenza..
Questi elettroni si trovano principalmente nella formazione di legami e nella reazione chimica con altri atomi. Pertanto, gli elettroni di valenza sono responsabili delle diverse proprietà chimiche e fisiche di un elemento (Valence Electrons, S.F.).
L'azoto, come accennato prima, ha un numero atomico Z = 7. Ciò implica che il suo riempimento di elettroni nei loro livelli di energia, o configurazione elettronica, è 1SDue 2SDue 2 P3.
Va ricordato che in natura gli atomi cercano sempre di avere la configurazione elettronica dei gas nobili, guadagnando, perdendo o condividendo elettroni..
Nel caso dell'azoto, il gas nobile che cerca di avere una configurazione elettronica è il neon, il cui numero atomico è Z = 10 (1SDue 2SDue 2 P6) e l'elio, il cui numero atomico è Z = 2 (1SDue) (Reusch, 2013).
I diversi modi in cui l'azoto deve combinarsi gli daranno la sua valenza (o stato di ossidazione). Nel caso specifico dell'azoto, poiché si trova nel secondo periodo della tavola periodica, non è in grado di espandere il suo guscio di valenza come fanno gli altri elementi del suo gruppo..
Ci si aspetta che abbia valenze di -3, +3 e +5. Tuttavia, l'azoto ha stati di valenza che vanno da -3, come nell'ammoniaca e nelle ammine, a +5, come nell'acido nitrico. (Tyagi, 2009).
La teoria del legame di valenza aiuta a spiegare la formazione di composti, secondo la configurazione elettronica dell'azoto per un dato stato di ossidazione. Per questo, è necessario tenere conto del numero di elettroni nel guscio di valenza e di quanto rimane per acquisire la configurazione del gas nobile..
Composti azotati
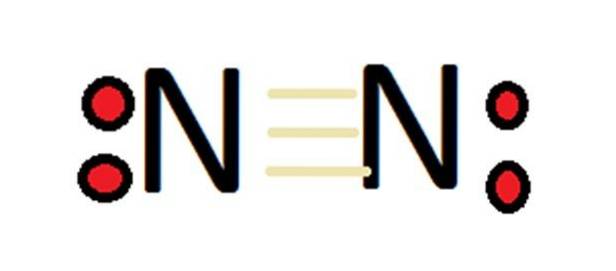
Dato il suo gran numero di stati di ossidazione, l'azoto può formare un gran numero di composti. In primo luogo, va ricordato che nel caso dell'azoto molecolare, per definizione, la sua valenza è 0.
Lo stato di ossidazione di -3 è uno dei più comuni per l'elemento. Esempi di composti con questo stato di ossidazione sono ammoniaca (NH3), ammine (R3N), ione ammonio (NH4+), immine (C = N-R) e nitrili (C≡N).
Nello stato di ossidazione -2, l'azoto viene lasciato con 7 elettroni nel suo guscio di valenza. Questo numero dispari di elettroni nel guscio di valenza spiega perché i composti con questo stato di ossidazione hanno un legame a ponte tra due azoto. Esempi di composti con questo stato di ossidazione sono le idrazine (RDue-N-N-RDue) e idrazoni (C = N-N-RDue).
Nello stato di ossidazione -1, l'azoto viene lasciato con 6 elettroni nel guscio di valenza. Esempio di composti azotati con questa valenza sono l'idrossilammina (RDueNOH) e i composti azoici (RN = NR).
Negli stati di ossidazione positivi, l'azoto è generalmente attaccato agli atomi di ossigeno per formare ossidi, ossisali o ossacidi. Per il caso dello stato di ossidazione +1, l'azoto ha 4 elettroni nel suo guscio di valenza.
Esempi di composti con questa valenza sono l'ossido di diazoto o il gas esilarante (N.DueO) e composti nitrosi (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
Per il caso dello stato di ossidazione di +2, un esempio è l'ossido di azoto o ossido nitrico (NO), un gas incolore prodotto dalla reazione di metalli con acido nitrico diluito. Questo composto è un radicale libero estremamente instabile poiché reagisce con ODue nell'aria per formare il gas NODue.
Nitrito (NODue-) in soluzione basica e acido nitroso (HNODue) in soluzione acida sono esempi di composti con stato di ossidazione +3. Questi possono essere agenti ossidanti per produrre normalmente NO (g) o agenti riducenti per formare lo ione nitrato..
Triossido di diazoto (NDueO3) e il gruppo nitro (R-NODue) sono altri esempi di composti azotati con valenza +3.
Biossido di azoto (NODue) o il biossido di azoto è un composto azotato con valenza +4. È un gas bruno generalmente prodotto dalla reazione dell'acido nitrico concentrato con molti metalli. Dimerizza per formare NDueO4.
Nello stato +5 troviamo nitrati e acido nitrico, che sono agenti ossidanti in soluzioni acide. In questo caso, l'azoto ha 2 elettroni nel guscio di valenza, che si trovano nell'orbitale 2S. (Stati di ossidazione dell'azoto, S.F.).
Esistono anche composti come nitrosilazide e triossido di diazoto in cui l'azoto ha vari stati di ossidazione nella molecola. Nel caso della nitrosilazide (N4O) l'azoto ha una valenza di -1, 0, + 1 e +2; e nel caso del triossido di diazoto, ha valenza +2 e +4.
Nomenclatura dei composti azotati
Data la complessità della chimica dei composti azotati, la nomenclatura tradizionale non era sufficiente per nominarli, tanto meno per identificarli correttamente. Ecco perché, tra le altre ragioni, l'Unione internazionale di chimica pura e applicata (IUPAC) ha creato una nomenclatura sistematica in cui i composti sono denominati in base al numero di atomi che contengono..
Questo è utile quando si tratta di denominare gli ossidi di azoto. Ad esempio l'ossido nitrico sarebbe denominato monossido di azoto e protossido di azoto (NO) monossido di diazoto (NDueO).
Inoltre, nel 1919, il chimico tedesco Alfred Stock sviluppò un metodo per denominare i composti chimici basato sullo stato di ossidazione, scritto in numeri romani racchiusi tra parentesi. Così, ad esempio, l'ossido nitrico e il protossido di azoto sarebbero chiamati rispettivamente ossido di azoto (II) e ossido di azoto (I) (IUPAC, 2005).
Riferimenti
- (2005). NOMENCLATURA DELLA CHIMICA INORGANICA Raccomandazioni IUPAC 2005. Recuperato da iupac.org.
- Stati di ossidazione dell'azoto. (S.F.). Recuperato da kpu.ca.
- Reusch, W. (2013, 5 maggio). Configurazioni elettroniche nella tavola periodica. Recupero da chemistry.msu.edu.
- Reusch, W. (2015, 8 agosto). Stati di ossidazione dell'azoto. Recupero da chem.libretexts.org.
- Sanderson, R. T. (2016, 12 dicembre). Elemento del gruppo azoto. Recuperato da britannica.com.
- Tyagi, V. P. (2009). Chimica essenziale XII. Nuova gastronomia: Ratna Sagar.
- Elettroni di valenza. (S.F.). Recupero da chemistry.tutorvista.com.
- Wandell, A. (2016, 13 dicembre). Chimica dell'azoto. Recupero da chem.libretexts.org.



Nessun utente ha ancora commentato questo articolo.