
La logica, i materiali, la tecnica e gli usi delle macchie di Wright

Il Macchia di Wright è una tecnica di colorazione creata dal patologo americano James Homer Wright nel 1902, basata sulla macchia di Romanowsky. Poiché la macchia di Romanowsky era instabile, Wright incorporò il metanolo come solvente e fissativo..
Questa colorazione è policromatica, il che significa che genera più colori a seconda della struttura che assorbe il colorante. Questa tecnica di colorazione è stata ampiamente utilizzata per eseguire la conta differenziale dei globuli bianchi e per studiare la morfologia dei globuli rossi, delle piastrine e dei leucociti nel sangue periferico e nel midollo osseo..
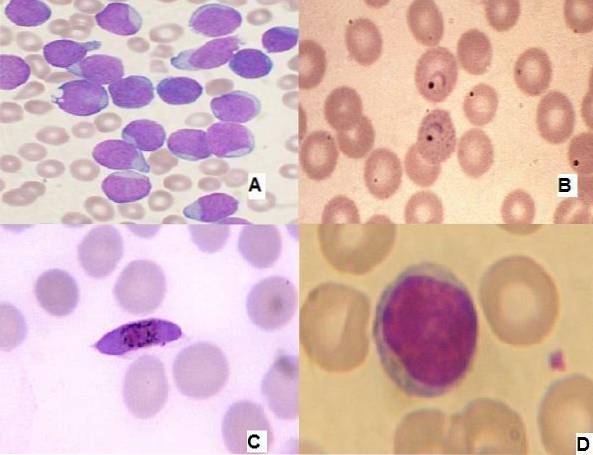
La sua applicazione è molto importante, poiché si possono riscontrare anomalie nelle diverse linee cellulari del sangue, facilitando la diagnosi di malattie come leucemie o infezioni batteriche o parassitarie..
Forse queste sono le applicazioni più comuni in cui viene utilizzata questa tecnica, tuttavia non sono le uniche. È anche utile in campioni diversi dal sangue e dal midollo osseo, come secrezioni nasali, muco fecale, espettorato, campioni di pelle, tra gli altri..
Indice articolo
- 1 Razionale per la macchia di Wright
- 2 Materiali
- 2.1 Preparazione
- 2.2 Soluzione tampone
- 2.3 Materiali aggiuntivi necessari per eseguire la colorazione
- 3 componenti della macchia di Wright
- 3.1 Metanolo
- 3.2 L'ammortizzatore
- 3.3 Eosina (Y)
- 3.4 Blu di metilene
- 4 Tecnica
- 5 Utilità
- 5.1 Ematologia
- 5.2 Secrezione nasale
- 5.3 Parassitologia
- 5.4 Infezioni respiratorie
- 5.5 Batteriologia
- 5.6 Micologia
- 6 Come vengono osservate le strutture del campione di sangue con la colorazione di Wright?
- 7 consigli per una buona colorazione
- 8 Errori comuni nella colorazione di Wright
- 8.1 Colorazione molto pallida
- 8.2 Il colorante precipita
- 8.3 Macchie con colorazione estremamente rossastra o blu
- 9 Modalità di archiviazione
- 10 riferimenti
Razionale per la macchia di Wright
La macchia di Wright è nata dalla macchia di Romanowsky, che consiste in una soluzione di alcol metilico di un colorante acido (eosina Y) e un colorante basico (blu di metilene) e dei loro prodotti di ossidazione..
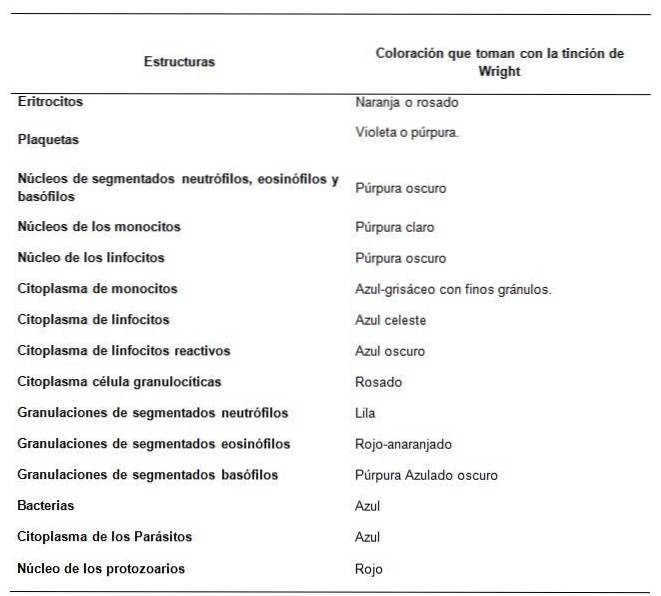
La miscela di coloranti utilizzata nella colorazione di Wright provoca l'effetto noto come Romanowsky, cioè fornisce una bella colorazione viola ai nuclei dei leucociti e dei granuli neutrofili, mentre i globuli rossi si colorano di rosa..
I componenti responsabili di dare la tipica gamma di colori della macchia di Wright sono il blu B e l'eosina Y. L'effetto osservato dipenderà dal legame dei coloranti alle strutture chimiche e dalle interazioni del blu B e dell'eosina Y.
Strutture acide come gli acidi nucleici, le proteine nucleari e il citoplasma reattivo immaturo di alcuni tipi di cellule, fissano il blu B (colorazione di base).
Mentre le strutture di base come l'emoglobina, i granuli di eosinofili segmentati, tra le altre strutture cellulari, legano l'eosina Y (colorante acido).
Il risultato della colorazione può essere influenzato da diversi fattori, come il pH del colorante Wright, il tampone e la soluzione di lavaggio; così come il tempo di colorazione e fissazione.
Pertanto, ogni fase della preparazione dei reagenti è fondamentale e deve essere eseguita curando ogni dettaglio..
Materiali
La macchia di Wright. Per 100 ml è necessario:
Pesare 0,3 g di macchia di Wright, misurare 97 ml di metanolo e 3 ml di glicerolo.
Preparazione
In un mortaio, posizionare la quantità pesante di macchia di Wright e incorporare gradualmente il glicerolo fino a quando la polvere è completamente sciolta..
Successivamente, il metanolo viene aggiunto, miscelato e versato in una bottiglia ambrata.
Prima dell'uso, la soluzione deve essere agitata con movimenti delicati e filtrata.
Soluzione tampone tamponata
In un litro di acqua distillata, aggiungere 3,76 g di disodio idrofosfato (NaDueHPO4 2HDue0) più 2,1 g di fosfato diidrogeno potassico (KHDuePO4).
Mescolare molto bene fino a quando tutti i reagenti incorporati si saranno sciolti. Regolare il pH a 7,2. Versare in un barattolo di vetro e conservare a temperatura ambiente.
Materiali aggiuntivi necessari per eseguire la colorazione
Inoltre, per poter eseguire la tecnica di colorazione sono necessari altri materiali, questi sono: oggetti scorrevoli o coprono oggetti, ponte per colorare, magliette con acqua o tampone per il lavaggio, un cronometro per mantenere i tempi di colorazione e del materiale assorbente. (carta assorbente, garza o cotone).
Componenti della macchia di Wright
Metanolo
L'alcol (metanolo) funge da fissativo dello striscio di sangue sul vetrino.
È fondamentalmente un reagente fissativo riducente, disidratante e coagulante. La sua funzione, quindi, è quella di coagulare le proteine e renderle insolubili, ma senza denaturarle effettivamente..
Il metanolo è il reagente di fissazione di strisci più utilizzato in tutti i laboratori, poiché fornisce risultati migliori rispetto all'etanolo. La concentrazione ideale è del 99%.
Ammortizzatore
Il tampone (soluzione tamponata) ha la funzione di regolare o mantenere il pH del colorante, poiché un pH regolato a 7,2 è essenziale affinché le strutture cellulari possano assorbire adeguatamente i coloranti..
D'altra parte, la fase di fissazione del metanolo disidrata le cellule e il tampone aiuta a reidratarle..
Eosina (Y)
L'eosina ha un'affinità per i mattoni perché è un colorante acido. Si conoscono due tipi di eosina molto simili tra loro, tanto da poter utilizzare l'uno o l'altro dei due ottenendo lo stesso risultato..
Uno è chiamato eosina Y, eosina gialla o tetrabromofluoresceina e l'altro è chiamato eosina B, eritrosina B bluastra o dibromodinitrofluoresceina. Tuttavia, l'eosina Y è la più comunemente usata.
La proprietà più importante di questo colorante è la sua polarità negativa, questo lo rende attratto da strutture cellulari caricate positivamente.
Blu di metilene
È la colorazione di base. La sua proprietà principale è la metacromasia, cioè non tutte le strutture saranno colorate dello stesso colore, dipende dalla composizione chimica delle strutture che vengono colorate..
Alcuni diventeranno blu chiaro o scuro e alcuni diventeranno viola scuro o lilla chiaro.
Tecnica
1-Eseguire la diffusione del campione in modo che rimanga una pellicola sottile, su un vetrino o un vetrino coprioggetto.
2-Lasciar asciugare all'aria per circa 2 ore.
3-Posizionare lo striscio asciutto sul ponte di colorazione o sul vassoio di colorazione con la diffusione del campione rivolta verso l'alto..
4-Coprire il foglio con la macchia di Wright goccia a goccia fino a coprire l'intera superficie. Lasciare in posa 5-8 minuti.
5-La macchia dovrebbe coprire completamente il vetrino, senza fuoriuscire dai bordi. Se durante il tempo di colorazione inizia ad evaporare, aggiungere qualche goccia in più.
6-Successivamente aggiungere una quantità uguale di ammortizzatore, soffiare un po 'fino a quando non appare la caratteristica lucentezza metallica. Tempi da 10 a 15 minuti.
7-Lavare con acqua di rubinetto, posizionando il flusso delicato fino a quando il foglio non appare rosa.
8-Con una garza impregnata di alcool, rimuovere il colorante aderito al retro del vetrino.
9-Lasciare asciugare bene lo striscio prima di mettere l'olio da immersione per vederlo al microscopio.
Utilità
Ematologia
È ideale per la colorazione di strisci di sangue periferico, per l'esame di strisci di sangue denso e per lo studio di cellule da campioni di midollo osseo.
A causa delle proprietà chimiche di questa combinazione di coloranti, le strutture cellulari possono essere facilmente riconosciute, potendo distinguere i diversi tipi di cellule presenti.
Rinorrea
Questa tecnica è molto utile per identificare le cellule della secrezione nasale (cellule epiteliali, eosinofili segmentati, cellule polimorfonucleate) nella diagnosi della rinite allergica..
parassitologia
In questo senso, è stato utile per lo studio di Leishmania sp all'interno degli istiociti del tessuto cellulare sottocutaneo nelle ulcere cutanee. Allo stesso modo, viene utilizzato per identificare i leucociti nei campioni di feci (leucogramma fecale).
In questo caso, è di interesse per il medico sapere se la leucocitosi presente nelle feci è polimorfonucleare o mononucleare. Questa scoperta nel leucogramma fecale guiderà se si tratta rispettivamente di un'infezione batterica o virale..
D'altra parte, i parassiti che circolano nel sangue possono essere trovati all'interno degli eritrociti o liberi nel plasma. I parassiti ricercati sono Plasmodium spp, Trypanosoma cruzii e filariae, e in medicina veterinaria è utile nella ricerca Theileria equi Y Babesia caballi, agenti causali della bebesiosi, specialmente negli equini.
La colorazione di Wright e anche la colorazione di Giemsa consentono di differenziare gli emoparassiti dai normali componenti cellulari. Per questo possono essere utilizzati due tipi di spread:
Si diffonde bene
Il sangue viene diffuso come una pellicola sottile su un vetrino. Colorato con la macchia di Wright, rivelando le caratteristiche del nucleo e del citoplasma.
Caduta spessa
Questa metodologia viene utilizzata per indagare la presenza di parassiti in una maggiore quantità di sangue..
Per fare ciò, una grande goccia di sangue viene posta su un vetrino. Una volta lì, deve essere defibrillato, creando cerchi sempre più grandi dal centro verso l'esterno, utilizzando il bordo di un altro vetrino..
Infine, per poter osservare i parassiti nello striscio spesso, gli eritrociti devono essere lisati con acqua..
Infezioni respiratorie
A livello respiratorio, questa tecnica è utile anche, perché le cellule presenti nei campioni di espettorato, lavaggio bronchiale o broncoalveolare, sono importanti per stabilire la diagnosi..
Allo stesso modo, qui si possono distinguere cellule polimorfonucleate e cellule mononucleate..
Batteriologia
L'uso di questa tecnica in batteriologia è limitato, perché non è utile per colorare i batteri, motivo per cui vengono utilizzate altre tecniche di colorazione specializzate per colorarli..
Tuttavia, è stato utilizzato per la ricerca di cellule epiteliali con corpi di inclusione di Chlamydia trachomatis negli strisci della mucosa uretrale o endocervicale, sebbene si debba riconoscere che non è il metodo migliore per questo.
È anche possibile osservare batteri a spirale come Borrelia burgdorferi in pazienti infetti, così come morule o corpi di inclusione di Ehrlichia sp nel citoplasma di linfociti, monociti o neutrofili in uno striscio di sangue.
Micologia
Il Histoplasma capsulatum è un fungo patogeno frequentemente diagnosticato dall'osservazione microscopica di vari campioni di tessuto, colorati con la macchia di Wright.
Come vengono osservate le strutture del campione di sangue con la macchia di Wright?
Raccomandazioni per una buona colorazione
Gli strisci dei campioni di sangue devono asciugare all'aria spontaneamente. Gli strisci dovrebbero essere il più sottili possibile per ottenere una migliore fissazione del colorante ed evitare la sovracolorazione..
Per una colorazione di alta qualità, si consiglia di colorare entro due ore dalla preparazione dello striscio. D'altra parte, il campione ideale è il sangue capillare, senza anticoagulante.
Tuttavia, se si utilizza sangue venoso, dovrebbe essere usato come anticoagulante EDTA e non eparina, poiché quest'ultima può deformare le strutture cellulari.
Per evitare il deterioramento del colorante preparato, conservarlo in luoghi asciutti.
Durante il processo di lavaggio si consiglia l'uso di acqua regolata a pH neutro..
Infine, si consiglia di testare ogni tanto i metodi di colorazione utilizzati in laboratorio..
Questo viene fatto colorando campioni o modelli estesi, come controllo di qualità. Questo passaggio è importante, in quanto garantisce che la colorazione sia adeguatamente preparata e che i tempi di colorazione siano ben standardizzati..
Se il foglio del modello è scarsamente colorato, ci sono problemi che devono essere risolti..
Errori comuni nella colorazione di Wright
Colorazione molto pallida
Le macchie molto chiare sono solitamente dovute a un tempo di colorazione molto breve o a un lavaggio eccessivo. Si corregge allungando il tempo di contatto con il colorante o diminuendo il tempo di lavaggio.
Il colorante precipita
La presenza di precipitati di colorante nello striscio può avere diverse cause, tuttavia, le cause più frequenti sono: uso di colorante non filtrato, macchie su ponti di colorazione irregolari, utilizzo di fogli sporchi di polvere o grasso, non lavare bene rifinire la colorazione.
Macchia estremamente rossa o blu
Il tampone è responsabile del pH del colorante. I coloranti con un pH inferiore a quello indicato (acido) produrranno macchie molto rossastre..
Se il pH del colorante è superiore (alcalino) si otterrà una macchia estremamente bluastra.
Modalità di archiviazione
Il reagente deve essere conservato a temperatura ambiente.
Riferimenti
- Gutiérrez V. Studio comparativo tra il metodo di colorazione di Wright e il test Elisa per la diagnosi di Ehrlichiosi canina nella città di San Pedro Sula, Honduras. 2008. Tesi di Laurea per l'abilitazione al Titolo di Medico Veterinario. Università di San Carlos del Guatemala.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Colorazioni di base nel laboratorio di microbiologia. Ricerca sulla disabilità. 2014; 3 (1): 10-18.
- "Macchia di Wright." Wikipedia, l'enciclopedia libera. 18 maggio 2018, 12:05 UTC. 8 dicembre 2018, 20:37
- Calderón A, Cardona J, Vergara Ó. Frequenza di Babesia spp. sui cavalli montería, Córdoba (Colombia). Rev. udcaactual divulg cient. 2013; 16 (2): 451-458.
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Argentina. Editoriale Panamericana S.A.
- Retamales E, Mazo V. Institute of Public Health Government of Chile. Raccomandazioni per la colorazione di strisci di sangue per la lettura dell'emocromo.



Nessun utente ha ancora commentato questo articolo.