
Struttura, tipi e funzioni delle proteine G
Il Proteine G. o proteine leganti il nucleotide della guanina, sono proteine associate alla membrana plasmatica appartenenti a una famiglia di proteine "accoppiatori" di segnale che hanno importanti funzioni in molti processi di trasduzione del segnale negli organismi eucarioti.
In letteratura le proteine G sono descritte come interruttori molecolari binari, poiché la loro attività biologica è determinata dai cambiamenti nella loro struttura dati dalle specie nucleotidiche a cui sono in grado di legarsi: nucleotidi guanosinici (difosfato (GDP) e trifosfato (GTP) ).
Sono generalmente attivati dai recettori di una famiglia di proteine note come recettori accoppiati a proteine G (GPCR).Recettori accoppiati a proteine G "), che ricevono un segnale iniziale esterno e lo convertono in cambiamenti conformazionali che innescano l'attivazione, che successivamente si traduce nell'attivazione di un'altra proteina effettrice.
Alcuni autori ritengono che i geni codificanti per questa famiglia di proteine si siano evoluti per duplicazione e divergenza di un gene ancestrale comune, il cui prodotto era sempre più raffinato e specializzato.
Tra la grande varietà di funzioni cellulari che queste proteine hanno ci sono la traslocazione di macromolecole durante la sintesi proteica, la trasduzione di segnali ormonali e stimoli sensoriali, nonché la regolazione della proliferazione e differenziazione cellulare..
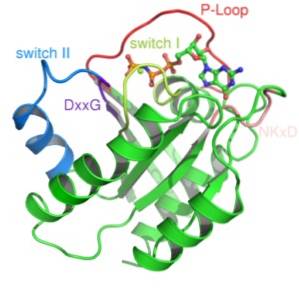
Sono state descritte due classi di questo tipo di proteine: proteine G piccole e proteine G eterotrimeriche. La prima struttura tridimensionale di una proteina G è stata ottenuta più di dieci anni fa da una piccola proteina G nota come Ras.
Indice articolo
- 1 Struttura
- 2 tipi
- 2.1 proteine G piccole
- 2.2 Proteine G eterotrimeriche
- 3 funzioni
- 3.1 Come funzionano?
- 4 Riferimenti
Struttura
Strutturalmente si riconoscono due tipi di proteine G: le proteine G piccole e le proteine G eterotrimeriche molto più complesse..
Le piccole proteine G sono costituite da un singolo polipeptide di circa 200 residui amminoacidici e circa 20-40 kDa, e nella loro struttura è presente un dominio catalitico conservato (il dominio G) composto da cinque α-eliche, sei fogli β-piegati e cinque anelli polipeptidici.
Le proteine G eterotrimeriche, d'altra parte, sono proteine di membrana integrali composte da tre catene polipeptidiche, note come subunità α, β e γ..
-La subunità α pesa tra 40 e 52 kDa, ha una regione di legame del nucleotide della guanina e ha attività GTPasi per idrolizzare i legami tra i gruppi fosfato di GTP..
Le subunità α di diverse proteine G condividono alcuni domini strutturali come quelli per il legame e l'idrolisi del GTP, ma sono molto diversi nei loro siti di legame per il recettore e le proteine effettrici..
-La subunità β ha un peso molecolare leggermente inferiore (tra 35 e 36 kDa).
-La subunità γ, invece, è molto più piccola e ha un peso molecolare approssimativo di 8 kDa..
Tutte le proteine G eterotrimeriche hanno 7 domini transmembrana e condividono la somiglianza di sequenza con i domini β e γ. Questi due domini sono così fortemente associati da essere visti come una singola unità funzionale..
Tipi
Come accennato in precedenza, esistono due tipi di proteine G: piccole ed eterotrimeriche..
Le proteine G piccole hanno ruoli nella crescita cellulare, nella secrezione proteica e nell'interazione delle vescicole intracellulari. Da parte loro, le proteine G eterotrimeriche sono associate alla trasduzione di segnali dai recettori di superficie, e agiscono anche come interruttori che si alternano tra due stati a seconda del nucleotide associato..
Piccole proteine G
Queste proteine sono anche chiamate piccole GTPasi, piccole proteine leganti GTP o superfamiglia proteica Ras e formano una superfamiglia indipendente all'interno della grande classe di idrolasi GTP con funzioni regolatorie..
Queste proteine sono molto diverse e controllano più processi cellulari. Sono caratterizzati da un dominio di legame GTP conservato, il dominio "G". Il legame di questo nucleotide fosfato causa importanti cambiamenti conformazionali nel suo dominio catalitico in piccole proteine G..
La sua attività è strettamente correlata alle proteine attivanti la GTPasi (GAP).GTPase Activating Protein ") e con fattori di scambio nucleotidico della guanina (GEF)Fattore di scambio nucleotidico della guanina ").
Cinque classi o famiglie di piccole proteine G sono state descritte negli eucarioti:
-Ras
-Rho
-Rab
-Sar1 / Arf
-Corse
Le proteine Ras e Rho controllano l'espressione genica e le proteine Rho modulano anche la riorganizzazione del citoscheletro. Le proteine del gruppo Rab e Sar1 / Arf influenzano il trasporto vescicolare e le proteine Ran regolano il trasporto nucleare e il ciclo cellulare..
Proteine G eterotrimeriche
Questo tipo di proteina merita anche un'associazione con altri due fattori proteici, in modo che il percorso di segnalazione dall'ambiente esterno all'interno della cellula sia costituito da tre elementi nel seguente ordine:
- Il ricevitori accoppiati alle proteine G.
- Il Proteine G.
- Il proteina o il canali effettori
Esiste una grande diversità di proteine G eterotrimeriche e ciò è correlato alla grande diversità delle subunità α che esistono in natura, in cui è conservato solo il 20% della sequenza amminoacidica.
Solitamente le proteine G eterotrimeriche vengono identificate grazie alla diversità della subunità α, basata principalmente sulle loro somiglianze funzionali e di sequenza..
Le subunità α sono composte da quattro famiglie (la famiglia Gs, la famiglia Gi / o, la famiglia Gq e la famiglia G12). Ogni famiglia è composta da un diverso “isotipo” che, insieme, aggiunge più di 15 diverse forme di subunità α..
Famiglia G.S
Questa famiglia contiene rappresentanti che partecipano anche alla sovraregolazione delle proteine dell'adenilato ciclasi ed è espressa nella maggior parte dei tipi di cellule. È composto da due membri: Gs e Golf.
Il pedice "S " si riferisce alla stimolazione (dall'inglese "stimolazione ") e il pedice "olf " si riferisce a "odore" (dall'inglese "Olfatto"). Le proteine del golf sono espresse soprattutto nei neuroni sensoriali responsabili dell'olfatto.
Famiglia G.i / o
Questa è la famiglia più grande e diversificata. Sono espressi in molti tipi di cellule e mediano l'inibizione dipendente dal recettore di vari tipi di adenil ciclasi (il pedice "io " si riferisce all'inibizione).
Le proteine con le subunità α del gruppo Go sono espresse soprattutto nelle cellule del sistema nervoso centrale e hanno due varianti: A e B..
Famiglia G.che cosa
Le proteine con questa famiglia di subunità α sono responsabili della regolazione della fosfolipasi C. Questa famiglia è composta da quattro membri le cui subunità α sono espresse da geni differenti. Sono abbondanti nelle cellule del fegato, dei reni e dei polmoni.
Famiglia G.12
Questa famiglia è ubiquitariamente espressa negli organismi e non si sa con certezza quali siano esattamente i processi cellulari regolati tramite proteine con queste subunità..
Β e γ subunità
Sebbene la diversità delle strutture alfa sia decisiva per l'identificazione delle proteine eterotrimeriche, c'è anche molta diversità rispetto alle altre due subunità: beta e gamma..
Caratteristiche
Le proteine G partecipano alla "canalizzazione" dei segnali dai recettori sulla membrana plasmatica ai canali o agli enzimi effettori..
L'esempio più comune della funzione di questo tipo di proteina è nella regolazione dell'enzima adenilato ciclasi, un enzima responsabile della sintesi dell'adenosina 3 ', 5'-monofosfato o semplicemente AMP ciclico, una molecola che ha importanti funzioni come secondo messaggero in molti processi cellulari noti:
-Fosforilazione selettiva di proteine con funzioni specifiche
-Trascrizione genetica
-Riorganizzazione del citoscheletro
-Secrezione
-Depolarizzazione delle membrane
Partecipano anche indirettamente alla regolazione della cascata di segnalazione dell'inositolo (fosfatidilinositolo e suoi derivati fosforilati), responsabili del controllo dei processi calcio-dipendenti come la chemiotassi e la secrezione di fattori solubili..
Molti canali ionici e proteine di trasporto sono controllati direttamente dalle proteine della famiglia delle proteine G. Allo stesso modo, queste proteine sono coinvolte in molti processi sensoriali come la vista, l'olfatto, tra gli altri..
Come funzionano?
La modalità di interazione di una proteina G con le proteine effettrici è specifica per ciascuna classe o famiglia di proteine.
Per le proteine G accoppiate con recettori di membrana (proteine G eterotrimeriche), il legame di un nucleotide guaninico come GDP o guanosina difosfato alla subunità α provoca l'associazione delle tre subunità, formando un complesso noto come Gαβγ o G-GDP, attaccato alla membrana.
Se la molecola GDP viene successivamente scambiata con una molecola GTP, la subunità α attaccata a GTP si dissocia dalle subunità β e γ, formando un complesso separato noto come Gα-GTP, che è in grado di alterare l'attività dei suoi enzimi o proteine trasportatrici bersaglio.
L'attività idrolitica di questa subunità le consente di terminare l'attivazione, scambiando il GTP con un nuovo PIL, passando alla conformazione inattiva..
In assenza dei recettori eccitati che si associano alle proteine G, questo processo di scambio del PIL in GTP è molto lento, il che significa che le proteine G eterotrimeriche scambiano il PIL per GTP solo a una velocità fisiologicamente significativa quando sono legate ai loro recettori eccitati.
Riferimenti
- Gilman, G. (1987). Proteine G: trasduttori di segnali generati da recettori. Revisioni annuali in biochimica, 56, 615-649.
- Milligan, G. e Kostenis, E. (2006). Proteine G eterotrimeriche: una breve storia. British Journal of Pharmacology, 147, 546-555.
- Offermanns, S. (2003). Proteine G come trasduttori nella segnalazione transmembrana. Progressi in biofisica e biologia molecolare, 83, 101-130.
- Simon, M., Strathmann, M. P. e Gautam, N. (1991). Diversità delle proteine G nella trasduzione del segnale. Scienza, 252, 802-808.
- Syrovatkina, V., Alegre, K. O., Dey, R. e Huang, X. (2016). Regolazione, segnalazione e funzioni fisiologiche delle proteine G.. Giornale di biologia molecolare, 428(19), 3850-3868.

Nessun utente ha ancora commentato questo articolo.