
Fondotinta, preparazione e usi Medium MIO
Il mezzo MIO è un test biochimico utilizzato per aiutare nell'identificazione di specie di batteri appartenenti alla famiglia delle Enterobacteriaceae. È abbastanza nutriente ed è composto da glucosio, estratto di lievito, peptone, triptein, L-ornitina cloridrato, viola di bromocresolo e agar.
Il significato del suo acronimo (MIO) descrive ciascuno dei parametri che possono essere osservati in questo mezzo; motilità, indolo e ornitina. La motilità è la capacità del microrganismo di muoversi a causa della presenza di flagelli. Affinché questa proprietà possa essere osservata, la consistenza del terreno deve essere semisolida, quindi la preparazione contiene meno agar..
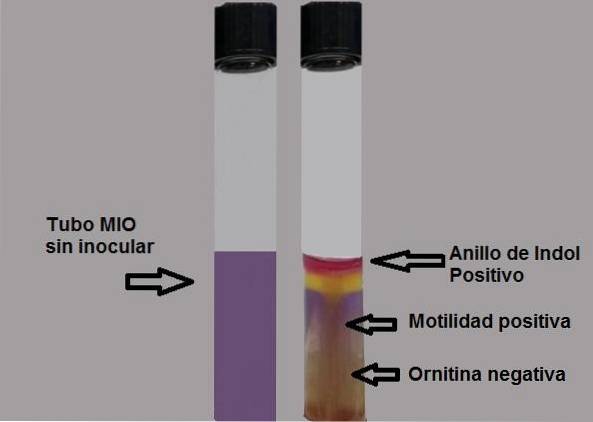
La produzione di indolo mostra la presenza dell'enzima triptofanasi che agisce sull'amminoacido triptofano, richiedendo l'uso di un reagente rivelatore per rendere visibile la produzione di indolo..
Infine, l'ornitina determina se il batterio è in grado di decarbossilare l'amminoacido, cioè se ha l'enzima orinitina decarbossilasi.
Indice articolo
- 1 Razionale
- 1.1 Peptone, estratto di lievito e triptein
- 1.2 Motilità
- 1.3 Glucosio
- 1.4 L-ornitina
- 1.5 Indicatore di pH
- 2 Tecnica di semina e sviluppo
- 3 Preparazione
- 3.1 MIO medio
- 3.2 Kovacs Reagent (Indole Test Developer)
- 4 Usa
- 5 Controllo di qualità
- 6 Riferimenti
Base
Peptone, estratto di lievito e triptein
Questi elementi contribuiscono al potere nutritivo di questo mezzo. Servono come fonte di nutrienti e aminoacidi essenziali per lo sviluppo batterico.
Inoltre, il triptein è una fonte di triptofano per dimostrare la presenza dell'enzima triptofanasi, che degrada il triptofano mediante deaminazione riduttiva, rilasciando indolo, acido piruvico, ammoniaca ed energia..
L'indolo è incolore, quindi la sua presenza si rivela aggiungendo cinque gocce di reagente di Ehrlich o di Kovacs, entrambi con p-dimetilamminobenzaldeide..
Il gruppo aldeidico di questo composto reagisce con l'indolo, generando un prodotto rosso fucsia a forma di anello sulla superficie dell'agar..
Qualsiasi traccia di colore deve essere considerata un test positivo. La bozza deve essere letta immediatamente, poiché nel tempo il colore si degrada.
Inoltre, questo test dovrebbe essere rivelato dopo che sono stati rilevati i risultati di motilità e decarbossilazione dell'ornitina..
Interpretazione
Test positivo: formazione di un anello rosso fucsia aggiungendo gocce del reagente di Kovacs.
Test negativo: nessuna formazione di anello.
Motilità
La capacità dei batteri di muoversi sarà evidenziata se si osserva un mezzo torbido o se c'è una linea di crescita spessa che si espande intorno all'inoculazione iniziale..
Un test di motilità negativo sarà evidenziato osservando una sottile linea di crescita e tutto ciò che lo circonda sarà senza crescita..
È importante che la motilità venga letta prima che l'indolo venga rivelato, poiché l'aggiunta del reagente annebbia l'intero terreno..
Nei batteri mobili ma a crescita lenta è difficile dimostrare la loro motilità con questo terreno. In questo caso, si consiglia di utilizzare altri test o metodi, come la motilità media o il metodo drop-pending..
Glucosio
Il glucosio è il carboidrato fermentescibile che, oltre a fornire energia, acidifica l'ambiente, condizione necessaria affinché avvenga la decarbossilazione dell'amminoacido ornitina..
La fermentazione del glucosio deve sempre avvenire, partendo dal principio che tutti i batteri appartenenti alla famiglia delle Enterobacteriaceae fermentano il glucosio..
L-ornitina
Nel caso in cui i batteri producano l'enzima ornitina decarbossilasi, questo può agire una volta che il terreno è stato acidificato dalla fermentazione del glucosio..
L'enzima ornitina decarbossilasi agisce sul gruppo carbossilico dell'amminoacido producendo un'ammina chiamata putresina che alcalinizza nuovamente il terreno.
Questo test dovrebbe essere letto dopo 24 ore di incubazione, perché se provi a leggere prima puoi interpretare male il test con un falso negativo.
Va ricordato che la prima reazione che si verifica è la fermentazione del glucosio, motivo per cui il mezzo diventa giallo in una fase iniziale (prime 10-12 ore). Se successivamente si verifica la decarbossilazione dell'ornitina, il terreno diventerà viola.
È importante interpretare il test di decarbossilazione dell'ornitina prima di rivelare l'indolo, poiché l'aggiunta del reagente di Kovacs modifica il colore del terreno..
Interpretazione
Test negativo: sfondo giallo medio o giallo.
Test positivo: metà completamente viola.
Indicatore di pH
In questo caso, viene utilizzato il bromocresolo viola; quello incaricato di rivelare quando c'è un cambiamento di pH nel mezzo. Quando acidificato, l'indicatore diventa giallo e quando alcalinizzato diventa viola.
Tecnica di semina e sviluppo
Per seminare il terreno MIO si utilizza un'ansa o un ago diritto e con esso viene raccolta una porzione della colonia da studiare..
Viene praticata una foratura profonda nel mezzo del MIO in linea retta. Non è consigliabile eseguire una doppia puntura, poiché può dare una falsa immagine di motilità se le punture non vengono eseguite nello stesso punto.
Incubare per 24-48 ore a 37 ° C in aerobiosi. Osservare i risultati in questo ordine: motilità, decarbossilazione dell'ornitina e infine rivelare l'indolo.
Si consiglia di rimuovere asetticamente 2 ml del terreno, trasferirlo in una provetta sterile ed eseguire lì il test dell'indolo, in modo che se è negativo, il resto della provetta originale può essere incubato per altre 24 ore, per rivelare il indole di nuovo..
Lo sviluppo dell'indolo viene effettuato come segue: si aggiungono da 3 a 5 gocce del reagente di Kovacs al terreno MIO e si agita vigorosamente. Si osserva se appare o meno un anello fucsia rosso.
Preparazione
MIO medio
Pesare 31 g di MIO medium e sciogliere in un litro di acqua distillata..
Riscaldare fino a quando la miscela bolle per un minuto, agitando spesso fino a quando l'agar non si è completamente sciolto. Distribuire 4 ml di terreno in 13/100 provette con tappi di cotone.
Sterilizzare in autoclave a 121 ° C per 15 minuti. Togliere dall'autoclave e lasciare riposare diritto su una griglia, in modo che si formi un blocco semisolido.
Conservare in frigorifero 2-8 ° C. Lasciar scaldare prima di seminare il ceppo batterico.
Il colore del terreno disidratato è beige e quello del terreno preparato leggermente viola opalescente..
Il pH finale del mezzo preparato è 6,5 ± 0,2
Il terreno diventa giallo a pH acido ed è viola a pH alcalino.
Reagente Kovacs (sviluppatore del test dell'indolo)
Questo reagente viene preparato come segue:
Si misurano 150 ml di alcol amilico, isoamilico o butilico (uno qualsiasi dei tre). In esso vengono sciolti 10 g di p-dimetilamminobenzaldeide. Successivamente si aggiungono lentamente 50 ml di acido cloridrico concentrato..
Il reagente preparato è incolore o giallo chiaro. Va conservato in una bottiglia color ambra e conservato in frigorifero. Un colore marrone scuro mostra il suo deterioramento.
Anche il reagente Kovacs può essere sostituito con il reagente Ehrlich. Quest'ultimo, essendo più sensibile, è preferito rivelare l'indolo nei batteri che lo producono in quantità minime, come in alcuni bastoncini Gram negativi non fermentanti e in alcuni anaerobi..
Uso
Questo terreno è un test che integra una batteria di test biochimici per l'identificazione di batteri appartenenti alla famiglia delle Enterobacteriaceae..
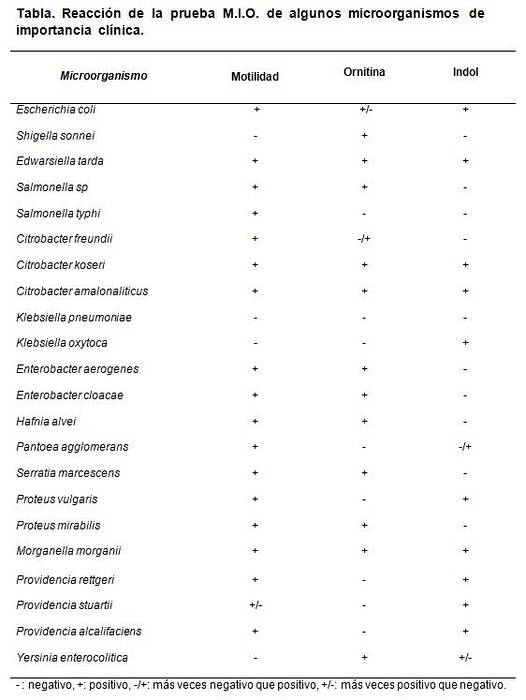
I dati della decarbossilazione dell'ornitina servono a differenziarli Shigella sonnei, che dà positivo, di Shigella boydii, Shigella flexneri e S. dysenterieae, che danno negativi.
Inoltre differenzia il genere Klebsiella, che risulta negativo, dal genere Enterobacter, dove la maggior parte delle sue specie risulta positiva..
QA
Ogni volta che viene preparato un lotto di terreno MIO, è possibile eseguire un test di controllo. Per questo, vengono utilizzati ceppi noti o certificati per osservare il comportamento del terreno..
I ceppi che possono essere utilizzati sono Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y Proteus mirabilis.
I risultati attesi sono E. coli e M. morganii. Dan M: +, I: + e O: +.
Klebsiella pneumoniae dà tutto negativo (M: -, I: -, O :-). Proteus mirabilis Y Enterobacter aerogenes dai M: + I: - e O: +.
Riferimenti
- Mac Faddin J. (2003). Test biochimici per l'identificazione di batteri di importanza clinica. 3a ed. Editoriale Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editoriale Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. 5a ed. Editoriale Panamericana S.A. Argentina.
- Britannia Laboratories. MIO Medio 2015, disponibile su: britanialab.com
- BD Laboratories. BBL Motility Indole Ornithine (MIO) Medium. 2007. Disponibile su: bd.com
- Valtek Laboratories. M.I.O. medio Motilità, indolo, ornitina. 2010 Disponibile su: andinamedica.com



Nessun utente ha ancora commentato questo articolo.