
Struttura, proprietà, usi del cloruro di cromo (CrCl3)
Il cloruro di cromo (CrCl3) è un sale inorganico composto da cationi Cr3+ e Cl anioni- in un rapporto 1: 3; cioè, per ogni Cr3+ ci sono tre Cl-. Come si vedrà in seguito, le loro interazioni non sono ioniche. Questo sale può essere presentato in due forme: anidro ed esaidrato..
La forma anidra è caratterizzata dall'avere un colore rosso violaceo; mentre l'esaidrato, CrCl3.6HDueOppure è verde scuro. L'incorporazione delle molecole d'acqua modifica le proprietà fisiche di detti cristalli; come i loro punti di ebollizione e fusione, densità, ecc..

Il cloruro di cromo (III) (secondo la nomenclatura di riserva) si decompone ad alte temperature, trasformandosi in cloruro di cromo (II), CrClDue. È corrosivo per i metalli, sebbene sia utilizzato nella cromatura: una procedura in cui i metalli sono rivestiti con un sottile strato di cromo.
Il cr3+, Proveniente dal suo rispettivo cloruro, è stato utilizzato nel trattamento del diabete, soprattutto in pazienti con nutrizione parenterale totale (TPN), che non ingeriscono la quantità richiesta di cromo. Tuttavia, i risultati sono molto migliori (e più affidabili) se forniti come picolinato..
Indice articolo
- 1 Struttura del cloruro di cromo
- 1.1 Strati cristallini di anidro
- 2 Proprietà
- 2.1 Nomi
- 2.2 Formula chimica
- 2.3 Peso molecolare
- 2.4 Descrizione fisica
- 2.5 Punto di fusione
- 2.6 Punto di ebollizione
- 2.7 Solubilità in acqua
- 2.8 Solubilità in solventi organici
- 2.9 Densità
- 2.10 Temperatura di conservazione
- 2.11 Decomposizione
- 2.12 Corrosione
- 2.13 Reazioni
- 2,14 pH
- 3 Sintesi
- 4 Usi
- 4.1 Industriale
- 4.2 Terapie
- 5 Rischi
- 6 Riferimenti
Struttura in cloruro di cromo
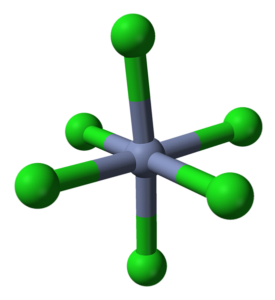
Il CrCl3 Nonostante sia un sale, la natura delle sue interazioni non è puramente ionica; hanno un certo carattere covalente, prodotto del coordinamento tra Cr3+ e Cl-, che danno origine a un ottaedro deformato (immagine in alto). Il cromo si trova al centro dell'ottaedro e il cloro nei suoi vertici.
L'ottaedro CrCl6 può, a prima vista, contraddire la formula CrCl3; tuttavia, questo ottaedro completo non definisce la cellula unitaria del cristallo, ma piuttosto un cubo (anch'esso deformato), che taglia a metà le sfere verdi o gli anioni di cloro.
Strati cristallini anidri
Pertanto, la cella unitaria con questo ottaedro mantiene ancora il rapporto 1: 3. Riproducendo questi cubi deformati nello spazio, si ottiene il cristallo CrCl3, che è rappresentato nell'immagine in alto con un modello di riempimento tridimensionale e un modello di sfere e barre.

Questo strato cristallino è uno dei tanti che compongono i fiocchi cristalli rosso-violacei di CrCl.3 (non confondere il colore del cristallo, vero, con quello delle sfere verdi).
Come si può vedere, gli anioni Cl- occupano la superficie, quindi le loro cariche negative respingono gli altri strati cristallini. Di conseguenza, i cristalli diventano friabili e fragili; ma brillante, per via delle cromature.
Se questi stessi strati sono visualizzati da una prospettiva laterale, si osserveranno, invece di ottaedri, tetraedri distorti:
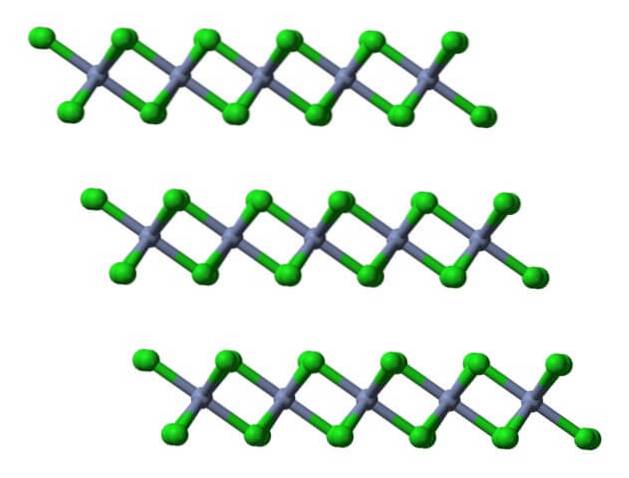
Qui è ulteriormente facilitata la comprensione del motivo per cui gli strati si respingono l'un l'altro quando gli anioni Cl si legano.- delle loro superfici.
Proprietà
Nomi
-Cloruro di cromo (III)
-Tricloruro di cromo (III)
-Cloruro di cromo (III) anidro.
Formula chimica
-CrCl3 (anidro).
-CrCl3.6HDueO (esaidrato).
Peso molecolare
-158,36 g / mol (anidro).
-266,43 g / mol (esaidrato).
Descrizione fisica
-Solidi e cristalli violetto-rossastro (anidri).
-Polvere cristallina verde scuro (esaidrato, immagine in basso). In questo idrato si può vedere come l'acqua inibisca la lucentezza, una caratteristica metallica del cromo.

Punto di fusione
-1.152 ºC (2.106 ºF, 1.425 K) (anidro)
-83 ºC (esaidrato).
Punto di ebollizione
1300ºC (2.370ºF, 1.570) (anidro).
Solubilità dell'acqua
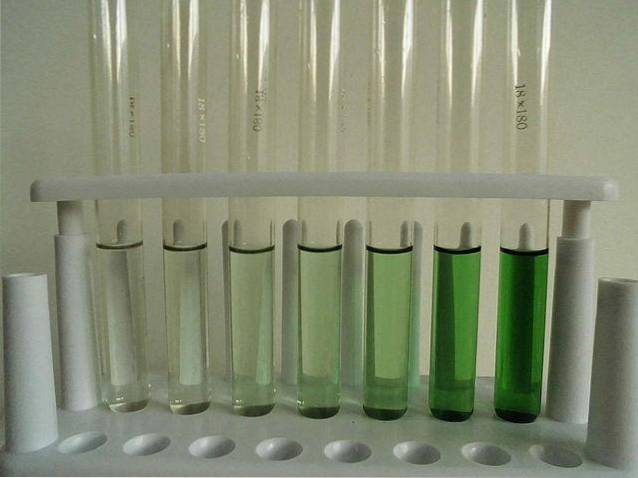
-Leggermente solubile (anidro).
-585 g / L (esaidrato).
L'immagine sopra mostra una serie di provette riempite con una soluzione acquosa di CrCl3. Si noti che più è concentrato, più intenso è il colore del complesso [Cr (OHDue)6]3+, responsabile del colore verde.
Solubilità in solventi organici
Solubile in etanolo, ma insolubile in etere (anidro).
Densità
-2.87 gr / cm3 (anidro).
-2,76 g / cm3 (esaidrato).
Temperatura di conservazione
Decomposizione
Quando riscaldato fino alla decomposizione, il cloruro di cromo (III) emette fumi tossici di composti contenenti cloro. Questi composti vengono rilasciati anche quando il cloruro di cromo (III) viene a contatto con acidi forti..
Corrosione
È altamente corrosivo e può attaccare alcuni acciai.
Reazioni
È incompatibile con forti ossidanti. Inoltre reagisce fortemente con litio e azoto..
Quando riscaldato in presenza di idrogeno, si riduce a cloruro di cromo (II), con formazione di acido cloridrico.
2 CrCl3 + HDue => 2 CrClDue + 2 HCl
pH
In una soluzione acquosa e con una concentrazione di 0,2 M: 2.4.
Sintesi
Il cloruro di cromo (III) esaidrato viene prodotto facendo reagire l'idrossido di cromo con acido cloridrico e acqua.
Cr (OH)3 + 3 HCl + 3 HDueO => CrCl3.6HDueO
Quindi, per ottenere il sale anidro, il CrCl viene riscaldato3.6HDueO in presenza di cloruro di tionile, SOClDue, acido cloridrico e calore:
[Cr (HDueO)6] Cl3 + 6SOClDue + ∆ → CrCl3 + 12 HCl + 6SODue
In alternativa, CrCl3 ottenuto facendo passare gas cloro su una miscela di cromo e ossido di carbonio.
CrDueO3 + 3 C + ClDue => 2 CrCl3 + 3 CO
E infine, essendo il metodo più utilizzato, è riscaldarne l'ossido con un agente alogenante, come il tetracloruro di carbonio:
CrDueO3 + 3CCl4 + ∆ → 2CrCl3 + 3COClDue
Applicazioni
Industriale
Il cloruro di cromo è coinvolto nella preparazione in situ del cloruro di cromo (II); reagente coinvolto nella riduzione degli alogenuri alchilici e nella sintesi degli alogenuri (E) -alchenilici.
-Viene utilizzato nella tecnica della cromatura. Consiste nel depositare, mediante galvanica, un sottile strato di cromo su oggetti metallici o altro materiale con scopo decorativo, aumentando così la resistenza alla corrosione ed anche la durezza superficiale..
-Viene utilizzato come mordente tessile, fungendo da collegamento tra il materiale di tintura e i tessuti da tingere. Inoltre, è utilizzato come catalizzatore per la produzione di olefine e agenti impermeabilizzanti..
Therapeutics
L'uso del supplemento di cloruro di cromo USP è raccomandato nei pazienti che ricevono solo soluzioni endovenose, somministrate per nutrizione parenterale totale (TPN). Pertanto, solo quando questi pazienti non ricevono tutte le loro esigenze nutrizionali.
Il cromo (III) fa parte del fattore di tolleranza al glucosio, un attivatore delle reazioni che promuovono l'insulina. Si ritiene che il cromo (III) attivi il metabolismo del glucosio, delle proteine e dei lipidi, facilitando l'azione dell'insulina nell'uomo e negli animali.
Il cromo è presente in molti alimenti. Ma la sua concentrazione non supera i 2 per porzione, essendo i broccoli l'alimento con il maggior contributo (11 µg). Inoltre, l'assorbimento intestinale del cromo è basso, con un valore compreso tra lo 0,4 e il 2,5% della quantità ingerita..
Ciò rende difficile stabilire una dieta per l'approvvigionamento di cromo. Nel 1989, la National Academy of Sciences ha raccomandato da 50 a 200 µg / giorno come apporto adeguato di cromo..
Rischi
Tra i possibili rischi di consumare questo sale come integratore di cromo ci sono:
-Forti dolori allo stomaco.
-Emorragia anormale, che può variare da difficoltà a guarire una ferita, lividi più rossi o oscuramento delle feci a causa di sanguinamento interno.
-Irritazioni all'apparato digerente, che provocano ulcere allo stomaco o all'intestino.
-Dermatite
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Cloruro di cromo (III). Estratto da: en.wikipedia.org
- Cloruro di cromo (III) [PDF]. Recupero da: alpha.chem.umb.edu
- PubChem. (2019). Cloruro di cromo esaidrato. Estratto da: pubchem.ncbi.nlm.nih.gov
- Istituto Nazionale della Salute. (21 settembre 2018). Cromo: scheda informativa sugli integratori alimentari. Estratto da: ods.od.nih.gov
- Tomlinson Carole A. (2019). Effetti collaterali del cloruro di cromo. Leaf Group Ltd. Estratto da: healthfully.com



Nessun utente ha ancora commentato questo articolo.