
Struttura, proprietà e usi del triossido di arsenico (As2O3)
Il triossido di arsenico è un composto inorganico la cui formula chimica è AsDueO3. L'arsenico nel suo stato metallico si trasforma rapidamente in questo ossido, che è un veleno molto tossico che può avere manifestazioni acute e croniche..
Poiché l'arsenico e l'ossigeno sono elementi del blocco p, con una differenza di elettronegatività relativamente bassa, si prevede che AsDueO3 è composto da una natura covalente; cioè che i legami As-O predominano nel suo solido, sulle interazioni elettrostatiche tra gli ioni As3+ meDue-.

L'intossicazione acuta da triossido di arsenico si verifica per ingestione o inalazione, le cui manifestazioni più importanti sono: gravi disturbi gastrointestinali, crampi, collasso circolatorio ed edema polmonare..
Tuttavia, nonostante la sua tossicità, è stato utilizzato industrialmente; ad esempio, nella conservazione del legno, nella produzione di pigmenti, semiconduttori, ecc. Allo stesso modo, è stato precedentemente utilizzato nel trattamento di numerose malattie.
Il triossido di arsenico è un composto anfotero, solubile in acidi e alcali diluiti, insolubile in solventi organici e relativamente solubile in acqua. Si presenta come un solido (immagine in alto), con due forme cristalline: cubica e monoclina.
Indice articolo
- 1 Struttura del triossido di arsenico
- 1.1 Claudetite
- 1.2 Liquido e gassoso
- 1.3 Arsenolite
- 2 Proprietà
- 2.1 Nomi commerciali
- 2.2 Peso molecolare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Aroma
- 2.6 Punto di ebollizione
- 2.7 Punto di fusione
- 2.8 Punto di infiammabilità
- 2.9 Solubilità in acqua
- 2.10 Solubilità
- 2.11 Densità
- 2.12 Pressione di vapore
- 2.13 Decomposizione
- 2.14 Corrosività
- 2.15 Calore di vaporizzazione
- 2.16 Costante di dissociazione (Ka)
- 2.17 Indice di rifrazione
- 3 Reattività
- 4 Nomenclatura
- 5 Usi
- 5.1 Industriale
- 5.2 Medici
- 6 Riferimenti
Struttura del triossido di arsenico
Claudetita
A temperatura ambiente AsDueO3 cristallizza in due polimorfi monoclinici, entrambi presenti nella claudetite minerale. Hanno unità piramidali trigonali AsO3, che sono uniti dai loro atomi di ossigeno per compensare da solo la carenza elettronica dell'unità.
In un polimorfo le unità AsO3 sono collegati formando file (claudetite I), e nell'altro sono legati come se stessero tessendo una rete (claudetite II):
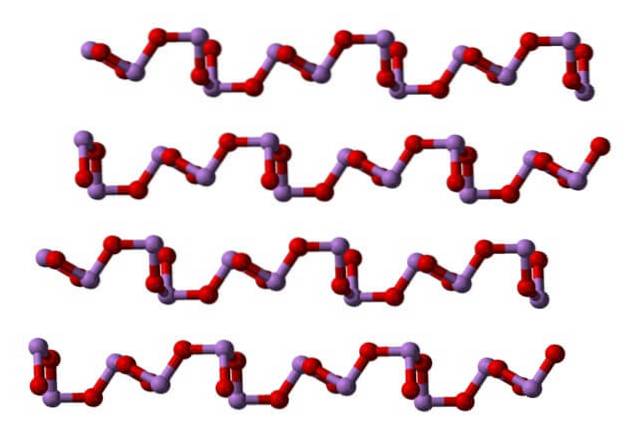
Liquido e gassoso
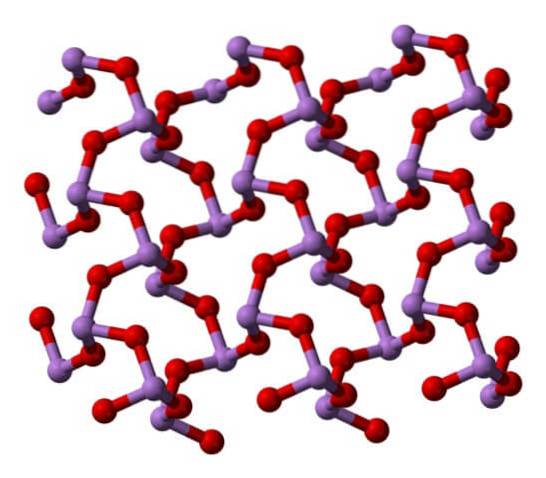
Quando tutte quelle strutture che definiscono i cristalli monoclinici vengono riscaldate, le vibrazioni sono tali che diversi legami As-O si rompono e una molecola più piccola finisce per prevalere: As4O6. La sua struttura è mostrata nell'immagine sottostante.

Si potrebbe dire che consiste in un dimero di AsDueO3. La sua stabilità è tale da supportare 800 ° C in fase gassosa; ma, al di sopra di questa temperatura, si frammenta in molecole di AsDueO3.
Arsenolite
Lo stesso Ace4O6 possono interagire tra loro per cristallizzarsi in un solido cubico, la cui struttura si trova nell'arsenolite minerale.
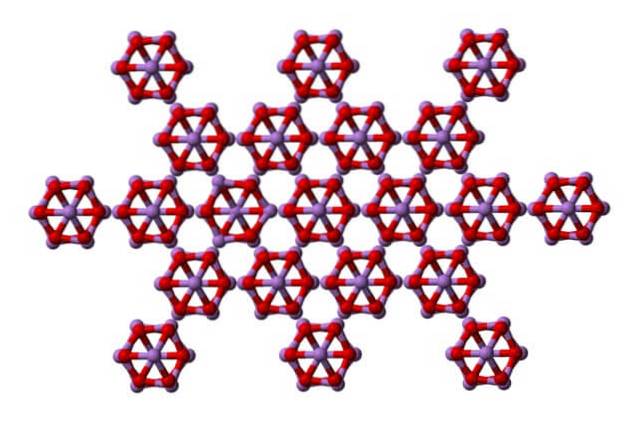
Notare che l'immagine mostra la struttura da un piano più alto. Confrontando con la claudetite, la sua differenza strutturale con l'arsenolite è evidente. Qui sono molecole discrete di As4O6 che le unità siano mantenute dalle forze di Van der Waals.
Proprietà
Nomi commerciali
-Arsenolite
-Arsodent
-Trisenox
-Claudetita
Peso molecolare
197,84 g / mol.
Aspetto fisico
-Cristalli cubici bianchi (arsenolite).
-Cristalli monoclinici incolori (Claudetite).
-Grumi bianchi o trasparenti solidi, vetrosi, amorfi o polvere cristallina.
Odore
Gabinetto.
Gusto
Insapore.
Punto di ebollizione
460 ºC.
Punto di fusione
-313 ºC (Claudetite).
-274 ºC (arsenolite).
punto di accensione
485 º C (sublima).
Solubilità dell'acqua
17 g / L a 18 ºC (20 g / L a 25 ºC).
Solubilità
Solubile in acidi (soprattutto acido cloridrico) e alcali. Praticamente insolubile in cloroformio ed etere.
Densità
-3,85 g / cm3 (cristalli cubici);
-4,15 g / cm3 (cristalli rombici).
Pressione del vapore
2.47 10-4 mmHg a 25 ºC.
Decomposizione
Non è combustibile, ma se riscaldato può creare fumo tossico che può includere arsina..
Corrosività
In presenza di umidità può essere corrosivo per i metalli.
Calore di vaporizzazione
77 kJ / mol.
Costante di dissociazione (Ka)
1.110-4 a 25 ºC.
Indice di rifrazione
-1.755 (arsenolite)
-1.92-2.01 (Claudetite).
Reattività
-Il triossido di arsenico è un composto anfotero, ma funziona preferenzialmente come un acido.
-Può reagire con acido cloridrico o acido fluoridrico, formando tricloruro di arsenico o trifluoruro di arsenico.
-Allo stesso modo, reagisce con forti ossidanti, come l'acido nitrico, causando acido arsenico e protossido di azoto..
-Il triossido di arsenico può reagire con l'acido nitrico, producendo arsina o l'elemento arsenico, a seconda delle condizioni di reazione..
AssoDueO3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NO3)Due + 3 oreDueO.
Questa reazione è servita come base per la creazione del Marsh Test, utilizzato per rilevare l'avvelenamento da arsenico..
Nomenclatura
ADueO3 Può essere nominato secondo le seguenti nomenclature, sapendo che l'arsenico funziona con valenza +3:
-Ossido arsenico (nomenclatura tradizionale).
-Ossido di arsenico (III) (nomenclatura stock).
-Triossido di diarsenico (nomenclatura sistematica).
Applicazioni
Industriale
-Viene utilizzato nella fabbricazione del vetro, in particolare come agente sbiancante. Viene anche utilizzato nella produzione di ceramiche, prodotti elettronici e fuochi d'artificio.
-Viene aggiunto come componente minore alle leghe a base di rame, per aumentare la resistenza alla corrosione dei metalli in lega.
-L'assoDueO3 è il materiale di partenza per la preparazione dell'arsenico elementare, per migliorare i collegamenti elettrici e per la produzione di semiconduttori all'arseniuro
-L'assoDueO3, oltre all'arseniato di rame, sono usati come preservanti del legno. È stato utilizzato in combinazione con acetato di rame per creare il pigmento verde di Parigi, utilizzato per realizzare pitture e rodenticidi..
Medici
-Il triossido di arsenico è un composto utilizzato da secoli nel trattamento di molte malattie. Era usato come tonico nel trattamento di disturbi nutrizionali, nevralgie, reumatismi, artriti, asma, corea, malaria, sifilide e tubercolosi.
-Allo stesso modo, è stato utilizzato nel trattamento locale delle malattie della pelle, essendo utilizzato per distruggere alcuni epiteliomi superficiali..
-La soluzione di Fowler è stata utilizzata per curare malattie della pelle e leucemia. L'uso di questo medicinale viene interrotto..
-Negli anni '70, il ricercatore cinese Zhang Tingdong ha condotto una ricerca sull'uso del triossido di arsenico nel trattamento della leucemia promielocitica acuta (APL). Ciò ha portato alla produzione del farmaco Trisenox, approvato dalla FDA statunitense.
-Trisenox è stato utilizzato in pazienti con LAP che non rispondono al trattamento "di prima linea", costituito da acido all-trans retinoico (ATRA). È stato dimostrato che il triossido di arsenico induce le cellule tumorali a subire l'apoptosi.
-Trisenox è usato come citostatico nel trattamento del sottotipo promielocitico refrattario (M3) di APL.
Riferimenti
- Shen et al. (2001). Studi sull'efficacia clinica e sulla farmacocinetica del triossido di arsenico a basse dosi nel trattamento della leucemia promielocitica acuta recidivante: un confronto con il dosaggio convenzionale. Leucemia 15, 735-741.
- Science Direct. (2014). Triossido di arsenico. Il Sevier. Estratto da: sciencedirect.com
- Wikipedia. (2019). Triossido di arsenico. Estratto da: en.wikipedia.org
- PubChem. (2019). Ossido di arsenico (III). Estratto da: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta e Steven L. Soignetb. (2001). Profilo rischio / beneficio del triossido di arsenico. The Oncologist vol. 6 Supplemento 2 29-32.
- Il New England Journal of Medicine. (11 luglio 2013). Acido retinoico e triossido di arsenico per la leucemia promielocitica acuta. n engl j med 369; 2.



Nessun utente ha ancora commentato questo articolo.