
Formula, caratteristiche e usi dell'acido perclorico

Il acido perclorico È un acido minerale molto forte, normalmente presente come soluzione acquosa incolore e inodore, corrosiva per metalli e tessuti. È un potente ossidante quando è caldo, ma le sue soluzioni acquose (fino a circa il 70% in peso) a temperatura ambiente sono generalmente sicure, mostrando solo forti caratteristiche acide e nessuna proprietà ossidante..
Acido perclorico e suoi sali (in particolare perclorato di ammonio [NH4ClO4, CAS: 7790-98-9], perclorato di sodio [NaClO4, 7601-89-0] e perclorato di potassio [KClO4, 7778-74- 7]), trovano molte applicazioni per il loro forte potere ossidante.

La sua produzione è aumentata grazie al suo utilizzo come materiale di partenza per la produzione di perclorato di ammonio puro, ingrediente base di esplosivi e propellenti solidi per razzi e missili..

L'acido perclorico è anche usato, su scala limitata, come reagente per scopi analitici. I suoi contenitori chiusi possono rompersi violentemente in caso di esposizione prolungata al calore..
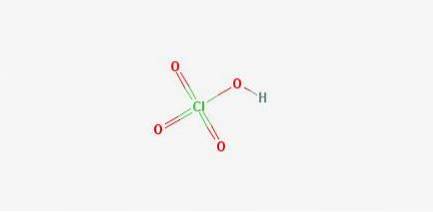
Formule: Acido perclorico: HClO4
CAS: 7601-90-3
Struttura 2D
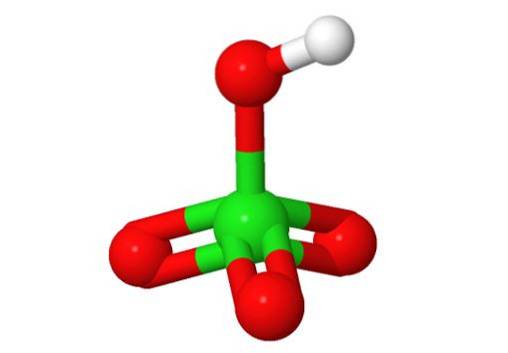
Struttura 3D
Caratteristiche dell'acido perclorico
Proprietà fisiche e chimiche
- Aspetto: liquido incolore
- Odore: inodore
- Peso molecolare: 100,454 g / mol
- Punto di ebollizione: 19 ° C
- Punto di fusione: -112 ° C
- Densità: 1,768 g / cm3
- Solubilità in acqua: miscibile
- Acidità (pKa): -15,2 (± 2,0)
L'acido perclorico appartiene al gruppo dei forti acidi ossidanti.
Infiammabilità
-Gli acidi ossidanti forti generalmente non sono infiammabili, ma possono accelerare la combustione di altri materiali fornendo ossigeno (agendo come agenti ossidanti).
-Le soluzioni di acido perclorico possono esplodere a causa del calore o della contaminazione.
-Se riscaldati a temperature superiori a 160 ° C o coinvolti in un incendio, possono decomporsi in modo esplosivo.
-Possono reagire in modo esplosivo con gli idrocarburi (combustibili). Può incendiare combustibili (legno, carta, olio, vestiti, ecc.).
-I contenitori possono esplodere se riscaldati.
-Il deflusso può creare un rischio di incendio o esplosione.
Reattività
-Gli acidi ossidanti forti sono generalmente solubili in acqua con il rilascio di ioni idrogeno. Le soluzioni risultanti hanno un pH di 1 o vicino a 1.
-I materiali di questo gruppo reagiscono con basi chimiche (ad esempio, ammine inorganiche e idrossidi) per formare sali. Queste reazioni di neutralizzazione si verificano quando la base accetta ioni idrogeno che l'acido dona.
-Le neutralizzazioni possono generare quantità di calore pericolosamente elevate in piccoli spazi.
-L'aggiunta di acqua agli acidi genera spesso abbastanza calore nella piccola regione della miscela per far bollire quella parte dell'acqua in modo esplosivo, il che può portare a schizzi di acido molto pericolosi..
-Questi materiali hanno una capacità significativa come agenti ossidanti, ma tale capacità varia da uno all'altro..
-Possono reagire con metalli attivi (come ferro e alluminio) e anche con molti metalli meno attivi, per sciogliere il metallo e rilasciare idrogeno e / o gas tossici.
-Le sue reazioni con i sali di cianuro e i suoi composti rilasciano acido cianidrico gassoso..
-Gas infiammabili e / o tossici sono generati anche dalle loro reazioni con ditiocarbammati, isocianati, mercaptani, nitruri, nitrili, solfuri e agenti riducenti deboli o forti..
-Ulteriori reazioni generatrici di gas avvengono con solfiti, nitriti, tiosolfati (per dare H2S e SO3), ditioniti (SO2) e anche carbonati: l'anidride carbonica di questi ultimi non è tossica ma il calore e gli schizzi della reazione possono essere sconvolti.
-Le soluzioni di acido perclorico sono forti soluzioni di acido ossidante.
-Possono reagire vigorosamente o esplodere, se miscelati con materiali ossidabili (alcoli, ammine, borani, dicianogeno, idrazine, idrocarburi, idrogeno, nitroalcani, metalli in polvere, silani e tioli, tra gli altri).
-L'acido perclorico si accende a contatto con il cloruro di solfinile.
Tossicità
-I forti acidi ossidanti sono corrosivi per i tessuti. I vapori acidi irritano gravemente i tessuti sensibili (come gli occhi e il sistema respiratorio).
-L'inalazione, l'ingestione o il contatto (della pelle, degli occhi, ecc.) Con soluzioni di acido perclorico o dei suoi vapori possono causare lesioni gravi, ustioni o morte..
-A contatto con il fuoco possono produrre gas irritanti, corrosivi e / o tossici..
-Il deflusso dal controllo del fuoco o dall'acqua di diluizione può causare contaminazione.
Applicazioni
-L'acido perclorico è utilizzato nei settori della ricerca scientifica e dello sviluppo e nella produzione di prodotti chimici e apparecchiature elettriche, elettroniche e ottiche.
-Viene utilizzato come precursore nella produzione di perclorato di ammonio puro, ingrediente base di esplosivi e propellenti solidi per razzi e missili..
-Gli usi dell'acido perclorico in casa includono WC, detergenti per metallo e scarichi, prodotti per rimuovere la ruggine, nelle batterie e come primer per unghie finte..
-Gli usi industriali includono: raffinazione dei metalli, idraulica, sbiancamento, incisione, galvanica, fotografia, disinfezione, munizioni, produzione di fertilizzanti, pulizia dei metalli e rimozione della ruggine.
-L'acido perclorico è anche usato, su scala limitata, come reagente per scopi analitici..
Effetti clinici
Gli acidi causano la necrosi della coagulazione. Gli ioni idrogeno essiccano le cellule epiteliali, provocando edema, eritema, perdita di tessuto e necrosi, con formazione di ulcere e piaghe da decubito..
In seguito all'esposizione a questi acidi per via gastrointestinale, i pazienti possono sviluppare ustioni di grado II (vesciche superficiali, erosioni e ulcerazioni) che sono a rischio di successiva formazione di stenosi, in particolare per via gastrica ed esofago..
Possono anche svilupparsi ustioni profonde e necrosi della mucosa gastrointestinale. Le complicanze includono spesso perforazione (esofagea, gastrica, raramente duodenale), formazione di fistole (tracheoesofageo, aortoesofageo) e sanguinamento gastrointestinale..
L'esposizione all'inalazione può causare dispnea, dolore toracico pleurico, tosse e broncospasmo, edema delle vie respiratorie superiori e ustioni. L'edema delle vie respiratorie superiori è comune e spesso pericoloso per la vita.
L'esposizione degli occhi può causare grave irritazione congiuntivale e chemosi, difetti della cornea epiteliale, ischemia limbica, perdita permanente della vista e nei casi gravi di perforazione..
Una lieve esposizione cutanea può causare irritazione e ustioni a spessore parziale. Un'esposizione a concentrazioni più lunghe o elevate può causare ustioni a tutto spessore.
Le complicanze possono includere cellulite, sepsi, contratture, osteomielite e tossicità sistemica.
Sicurezza e rischi
Indicazioni di pericolo del Sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS)
Il sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) è un sistema concordato a livello internazionale, creato dalle Nazioni Unite e progettato per sostituire i vari standard di classificazione ed etichettatura utilizzati nei diversi paesi utilizzando criteri coerenti a livello globale..
Le classi di pericolo (e il relativo capitolo GHS), gli standard di classificazione ed etichettatura e le raccomandazioni per l'acido perclorico sono i seguenti (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Dichiarazioni di rischio GHS
H271: Può provocare un incendio o un'esplosione; Forte ossidante [Pericolo Liquidi ossidanti; Solidi ossidanti - Categoria 1] (PubChem, 2017).
H290: Può essere corrosivo per i metalli [Attenzione corrosivo per i metalli - Categoria 1] (PubChem, 2017).
H302: Nocivo se ingerito [Attenzione Tossicità acuta, per via orale - Categoria 4] (PubChem, 2017).
H314: Provoca gravi ustioni cutanee e gravi lesioni oculari [Pericolo Corrosione / irritazione cutanea - Categoria 1A, B, C] (PubChem, 2017).
H318: Provoca gravi lesioni oculari [Pericolo Lesioni oculari gravi / irritazione oculare - Categoria 1] (PubChem, 2017).
H371: Può provocare danni agli organi [Attenzione Tossicità specifica per organi bersaglio, esposizione singola - Categoria 2] (PubChem, 2017).
Codici di istruzioni di attenzione
P210, P220, P221, P234, P260, P264, P270, P280, P283, P301 + P312, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P306 + P360, P309 + P311, P310, P321, P330, P363, P370 + P378, P371 + P380 + P375, P390, P404, P405 e P501 (PubChem, 2017).





Riferimenti
- Agenzia europea per le sostanze chimiche (ECHA). (2016). Acido perclorico. Breve profilo. Estratto l'8 febbraio 2017 da: echa.europa.eu.
- JSmol (2017) Acido perclorico. [immagine] Estratto da: chemapps.stolaf.edu.
- NASA (2008) Ares-1 launch 02-2008 [immagine] Estratto da: commons.wikimedia.org.
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem. (2017). Acido perclorico - Struttura di PubChem. [immagine] Bethesda, MD, EU: National Library of Medicine. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Oelen, W. (2011) Acido perclorico 60 percento [immagine] Estratto da: en.wikipedia.org.
- Wikipedia. (2017). Acido perclorico. Estratto l'8 febbraio 2017 da: es.wikipedia.org.
- Wikipedia. (2017). Acido perclorico. Estratto l'8 febbraio 2017 da: es.wikipedia.org.



Nessun utente ha ancora commentato questo articolo.