
Storia, espressione, esempi della legge di Boyle-Mariotte
La legge di Boyle-Mariotte È quello che esprime la relazione tra la pressione esercitata da o su un gas e il volume che occupa; mantenendo costante sia la temperatura del gas, sia la sua quantità (numero di moli).
Questa legge, insieme a quella di Charles, Gay-Lussac, Charles e Avogadro, descrive il comportamento di un gas ideale; in particolare, in un contenitore chiuso soggetto a variazioni di volume esercitate da una forza meccanica.
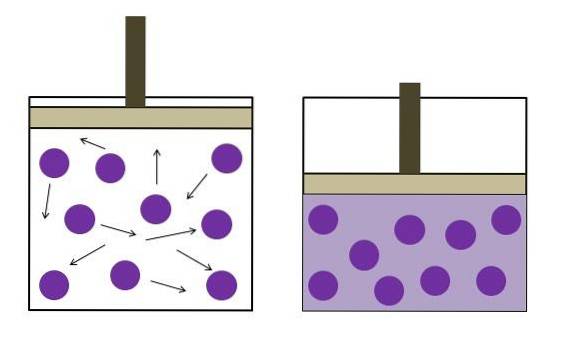
L'immagine sopra riassume brevemente la legge Boyle-Mariotte.
I punti viola rappresentano molecole di gas o atomi, che entrano in collisione con le pareti interne del contenitore (a sinistra). Man mano che lo spazio disponibile o il volume del contenitore occupato da questo gas diminuiscono, le collisioni aumentano, il che si traduce in un aumento della pressione (a destra).
Ciò mostra che la pressione P e il volume V del gas sono inversamente proporzionali se il contenitore è chiuso ermeticamente; in caso contrario, una pressione maggiore equivarrebbe a una maggiore espansione del vaso.
Se si facesse un grafico V contro P, con i dati di V e P sugli assi Y e X, rispettivamente, si osserverebbe una curva asintotica. Minore è la V, maggiore è l'aumento di P; ovvero, la curva si estenderà verso valori elevati di P sull'asse X..
Ovviamente la temperatura rimane costante; ma, se lo stesso esperimento fosse condotto a temperature differenti, le posizioni relative di queste curve V vs P cambierebbero sull'asse cartesiano. Il cambiamento sarebbe ancora più evidente se fosse tracciato su un asse tridimensionale, con T costante sull'asse Z..
Indice articolo
- 1 Storia della legge di Boyle
- 1.1 Contesto
- 1.2 Esperimento di mercurio
- 1.3 Edme Mariotte
- 1.4 Rafforzamento della legge
- 2 Cos'è questa legge?
- 3 Espressione matematica
- 4 A cosa serve? Quali problemi risolve la legge di Boyle?
- 4.1 Motori a vapore
- 4.2 Sorseggiare bevande
- 4.3 Sistema respiratorio
- 5 esempi (esperimenti)
- 5.1 Esperimento 1
- 5.2 Esperimento 2
- 6 Riferimenti
Storia della legge di Boyle
sfondo
Da quando lo scienziato Galileo Galilei espresse la sua convinzione nell'esistenza del vuoto (1638), gli scienziati iniziarono a studiare le proprietà dell'aria e dei vuoti parziali.
Il chimico anglo-irlandese, Robert Boyle, iniziò il suo studio delle proprietà dell'aria nel 1638 dopo aver appreso che Otto von Guericke, un ingegnere e fisico tedesco, aveva costruito una pompa d'aria..
Esperimento di mercurio
Per condurre i suoi studi sulla pressione dell'aria, Boyle ha utilizzato un tubo di vetro a forma di "J", la cui costruzione è stata attribuita a Robert Hooke, un assistente di Boyle. L'estremità del braccio corto era sigillata, mentre l'estremità del braccio lungo del tubo era aperta per posizionare il mercurio.
Fin dall'inizio, Boyle ha voluto studiare l'elasticità dell'aria, qualitativamente e quantitativamente. Versando mercurio attraverso l'estremità aperta del tubo "J", Boyle dedusse che l'aria nel braccio corto del tubo si stava contraendo sotto la pressione del mercurio..
Risultati
Maggiore è la quantità di mercurio aggiunta al tubo, maggiore è la pressione esercitata sull'aria e minore è il suo volume. Boyle ha ottenuto un grafico di tipo esponenziale negativo del volume d'aria in funzione della pressione.
Nel frattempo, se il volume d'aria è tracciato contro l'inverso della pressione, abbiamo una linea retta con una pendenza positiva.
Nel 1662 Boyle pubblicò la prima legge fisica fornita sotto forma di equazione, che indicava la dipendenza funzionale di due variabili. In questo caso, la pressione e il volume.
Boyle ha sottolineato che esisteva una relazione inversa tra la pressione esercitata su un gas e il volume occupato dal gas, questa relazione è relativamente vera per i gas reali. La maggior parte dei gas si comporta come gas ideali a temperature e pressioni moderate.
Man mano che si verificavano pressioni più elevate e temperature più basse, le deviazioni nel comportamento dei gas reali dagli ideali divennero più evidenti.
Edme mariotte
Il fisico francese Edme Mariotte (1620-1684) scoprì indipendentemente la stessa legge nel 1679. Ma ebbe il merito di dimostrare che il volume varia con la temperatura. Ecco perché si chiama Legge di Mariotte o Legge di Boyle e Mariotte..
Rafforzamento della legge
Daniel Bernoulli (1737) ha rafforzato la legge di Boyle sottolineando che la pressione di un gas è prodotta dall'impatto di particelle di gas sulle pareti del contenitore che lo contiene..
Nel 1845, John Waterston pubblicò un articolo scientifico, in cui si concentrò sui principi fondamentali della teoria cinetica dei gas..
Successivamente, Rudolf Clausius, James Maxwell e Ludqwig Boltzmann consolidarono la teoria cinetica dei gas, che mette in relazione la pressione esercitata da un gas con la velocità delle particelle di gas in movimento..
Minore è il volume del contenitore che contiene un gas, maggiore è la frequenza degli impatti delle particelle che lo formano contro le pareti del contenitore; e quindi, maggiore è la pressione esercitata dal gas.
Cos'è questa legge?
Gli esperimenti condotti da Boyle indicano che esiste una relazione inversa tra il volume occupato da un gas e la pressione esercitata su di esso. Tuttavia il rapporto indicato non è del tutto lineare, come indicato da un grafico della variazione del volume in funzione della pressione attribuita a Boyle.
La legge di Boyle indica che il volume occupato da un gas è inversamente proporzionale alla pressione. È anche indicato che il prodotto della pressione di un gas e il suo volume è costante.
Espressione matematica
Per arrivare all'espressione matematica della legge di Boyle-Mariotte, partiamo da:
V ∝ 1 / P
Dove indica che il volume occupato da un gas è inversamente proporzionale alla sua pressione. Tuttavia, esiste una costante che determina quanto sia inversamente proporzionale questa relazione.
V = k / P
Dove k è la costante di proporzionalità. Risolvendo per k abbiamo:
VP = k
Il prodotto della pressione di un gas e del suo volume è costante. Poi:
V1P1 = k e VDuePDue = k
E da ciò si può dedurre che:
V1P1 = VDuePDue
Quest'ultima è l'espressione o l'equazione finale per la legge di Boyle.
Cosa serve? Quali problemi risolve la legge di Boyle?
Motori a vapore

La legge Boyle-Mariotte viene applicata nel funzionamento delle macchine a vapore. È un motore a combustione esterna che utilizza la trasformazione dell'energia termica di una quantità di acqua in energia meccanica.
L'acqua viene riscaldata in una caldaia a chiusura ermetica, e il vapore prodotto esercita una pressione secondo la legge di Boyle-Mariote che produce un'espansione di volume di un cilindro spingendo un pistone.
Il movimento lineare del pistone si trasforma in un movimento rotatorio, attraverso l'utilizzo di un sistema di bielle e manovelle, che possono azionare le ruote di una locomotiva o il rotore di un generatore elettrico..
Attualmente, il motore a vapore alternativo è un motore poco utilizzato, poiché è stato sostituito dal motore elettrico e dal motore a combustione interna nei veicoli da trasporto.
Sorseggia un drink
L'azione di succhiare una bibita o un succo da una bottiglia attraverso un tubo di plastica è correlata alla legge Boyle-Mariotte. Quando l'aria viene aspirata dal tubo utilizzando la bocca, si verifica una diminuzione della pressione all'interno del tubo.
Questa caduta di pressione facilita il movimento verso l'alto del liquido nel tubo, permettendone l'ingestione. Questo stesso principio funziona nel prelevare il sangue attraverso l'uso di una siringa..
Sistema respiratorio
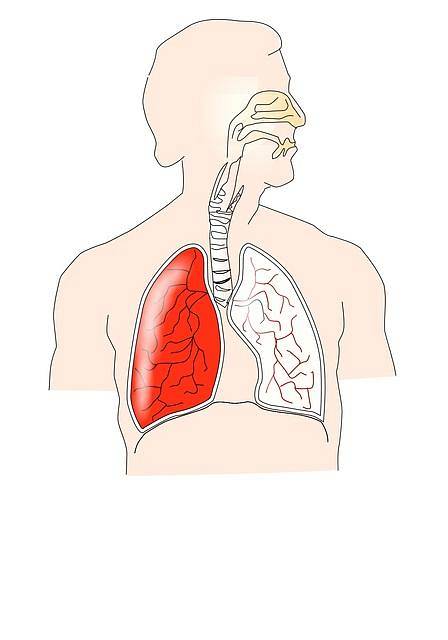
La legge di Boyle-Mariotte è strettamente correlata al funzionamento del sistema respiratorio. Durante la fase di inspirazione, il diaframma e altri muscoli si contraggono; per esempio, gli intercostali esterni che producono un'espansione della gabbia toracica.
Ciò provoca una diminuzione della pressione intrapleurica, provocando un'espansione polmonare che produce un aumento del volume polmonare. Pertanto, la pressione intrapolmonare diminuisce secondo la legge di Boyle-Mariotte.
Quando la pressione intrapolmonare diventa subatmosferica, l'aria atmosferica fluisce nei polmoni, provocando un aumento della pressione nei polmoni; equiparando così la sua pressione alla pressione atmosferica e concludendo la fase di inspirazione.
Successivamente, i muscoli inspiratori si rilassano e i muscoli espiratori si contraggono. Inoltre si verifica la retrazione polmonare elastica, fenomeno che produce una diminuzione del volume polmonare, con conseguente aumento della pressione intrapolmonare, spiegato dalla legge di Boyle-Mariotte..
Quando la pressione intrapolmonare aumenta e diventa maggiore della pressione atmosferica, l'aria fluisce dall'interno dei polmoni all'atmosfera. Ciò si verifica fino a quando le pressioni si equalizzano, il che conclude la fase di espirazione..
Esempi (esperimenti)
Esperimento 1
Si posiziona un palloncino ermeticamente chiuso, facendo un nodo in bocca, all'interno di una siringa, dalla quale è stato estratto lo stantuffo, di circa 20 ml. Lo stantuffo della siringa è posizionato verso il centro della siringa, l'ago è estratto e l'ingresso dell'aria è ostruito.
Osservazione
Tirando lentamente lo stantuffo dell'iniettore, si osserva che il palloncino si gonfia.
Spiegazione
Sulla parete del palloncino vengono esercitate due pressioni: una pressione sulla sua faccia interna, un prodotto dell'aria contenuta all'interno del palloncino, e un'altra pressione sulla faccia esterna del palloncino, esercitata dall'aria contenuta nella siringa..
Tirando lo stantuffo dell'iniettore si crea un semivuoto all'interno. Pertanto, la pressione dell'aria sulla faccia esterna della parete della pompa diminuisce, rendendo la pressione esercitata all'interno della pompa relativamente più alta..
Questa pressione netta, secondo la legge di Boyle-Mariote, produrrà una distensione della parete del pallone e un aumento del volume del pallone..
Esperimento 2
Una bottiglia di plastica viene tagliata all'incirca a metà, assicurandosi che il taglio sia il più orizzontale possibile. Un palloncino ben aderente viene posto nella bocca della bottiglia, allo stesso tempo una certa quantità di acqua viene posta in un piatto profondo.
Osservazione
Posizionando il fondo della bottiglia con il palloncino sopra l'acqua nel piatto, il palloncino si gonfia moderatamente.
Spiegazione
L'acqua sposta una certa quantità d'aria, aumentando la pressione dell'aria sulla parete della bottiglia e all'interno del palloncino. Ciò provoca, secondo la legge di Boyle-Mariotte, un aumento del volume del pallone, che viene visualizzato dal gonfiaggio del pallone..
Riferimenti
- Wikipedia. (2019). Legge di Boyle. Estratto da: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (27 luglio 2018). Legge di Boyle. Encyclopædia Britannica. Estratto da: britannica.com
- Helmenstine, Todd. (5 dicembre 2018). La formula per la legge di Boyle. Estratto da: thoughtco.com
- Giovani film indiani. (15 maggio 2018). Legge di Boyle: esperimento scientifico per bambini. Estratto da: yifindia.com
- Cecilia Bembibre. (22 maggio 2011). Mongolfiera. Definizione ABC. Estratto da: definicionabc.com
- Ganong, W, F. (2003). Fisiologia medica. (19a edizione). Editoriale del Manuale moderno.


Nessun utente ha ancora commentato questo articolo.