
Struttura, proprietà, usi e rischi dell'alcol isoamilico
Il alcool isoamilico è un composto organico la cui formula è (CH3)DueCHCHDueCHDueOH. Chimicamente parlando è un alcol primario ramificato e costituisce uno degli isomeri del pentanolo, chiamati alcoli amilici (C5H12O).
Come molti alcoli a basso peso molecolare, è un liquido incolore a temperatura ambiente. Ciò consente e facilita il suo utilizzo come solvente per diverse applicazioni; ancor di più, quando non esercita troppi effetti negativi sull'ecosistema dopo essere stato smaltito.
Sebbene sia un materiale intermedio nella sintesi dell'acetato di amile per la produzione di fragranze artificiali di banana, il suo odore è sgradevole e simile a quello delle pere..
Oltre a servire come solvente per molteplici sostanze biologiche, e come intermedio nella sintesi di altri acetati, riduce la tensione superficiale di alcune formulazioni industriali, prevenendo la formazione di schiume. Pertanto, è utilizzato nei sistemi microemulsionati.
Per quanto riguarda la sua origine naturale, l'alcool isoamilico è stato trovato nei feromoni dei calabroni e nel tartufo nero, un tipo di fungo situato nell'Europa sud-orientale.
Indice articolo
- 1 Struttura dell'alcol isoamilico
- 1.1 Interazioni intermolecolari
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Odore e sapore
- 2.3 Massa molare
- 2.4 Densità
- 2.5 Densità del vapore
- 2.6 Pressione di vapore
- 2.7 Punto di ebollizione
- 2.8 Punto di fusione
- 2.9 Punto di infiammabilità
- 2.10 Temperatura di autoaccensione
- 2.11 Solubilità
- 2.12 Viscosità
- 2.13 Tensione superficiale
- 2.14 Indice di rifrazione
- 2.15 Capacità termica
- 3 usi
- 3.1 Materia prima
- 3.2 Fragranze
- 3.3 Antischiuma
- 3.4 Estrazioni
- 4 Rischi
- 4.1 Conservazione e reattività
- 4.2 Salute
- 5 Riferimenti
Struttura dell'alcool isoamilico
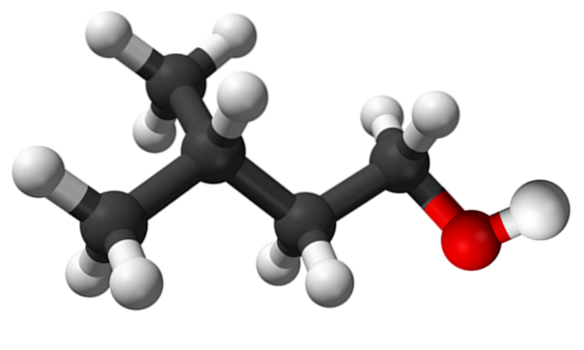
L'immagine in alto mostra la molecola di alcol isoamilico rappresentata con un modello di sfere e barre. Alla sua destra, la sfera rossastra corrisponde all'atomo di ossigeno del gruppo OH, caratteristico di tutti gli alcoli; mentre a sinistra è lo scheletro di carbonio con un gruppo metile, CH3, struttura ramificata.
Da un punto di vista molecolare, questo composto è dinamico perché ha atomi con ibridazioni sp3, facilitare la rotazione dei tuoi link; fintanto che non provoca l'eclissi di OH e CH3.
Da segnalare anche la sua caratteristica anfifilica: ha un'estremità apolare o idrofobica, costituita dalla catena (CH3)DueCHCHDueCHDue-, e una testa polare o idrofila, il gruppo OH. Questa definizione di due aree specifiche di diversa polarità rende questo alcol un tensioattivo; e quindi la sua applicazione per microemulsioni.
Interazioni intermolecolari
Data la presenza del gruppo OH, la molecola di alcol isoamilico mostra un momento di dipolo permanente. Di conseguenza, le forze dipolo-dipolo riescono a legare le loro molecole, responsabili delle proprietà fisiche e misurabili del liquido, nonché del suo odore..
Sebbene la ramificazione delle catene principali diminuisca le interazioni effettive tra le molecole, i legami idrogeno in questo alcool compensano questa diminuzione, facendo bollire il liquido a 131 ° C, una temperatura superiore al punto di ebollizione dell'acqua..
Non lo stesso accade con il suo solido o "ghiaccio", che si scioglie a -117 ° C, indicando che le sue interazioni intermolecolari non sono abbastanza forti da mantenere le sue molecole in ordine; soprattutto se il gruppo CH3 che ramifica la catena principale impedisce un migliore contatto tra le molecole.
Proprietà
Aspetto fisico
Liquido incolore.
Odore e gusto
Emana un odore sgradevole simile alla pera e ha un sapore pungente.
Massa molare
88,148 g / mol.
Densità
0,8104 g / mL a 20 ° C. È quindi meno denso dell'acqua.
Densità del vapore
È 3,04 volte più denso dell'aria.
Pressione del vapore
2,37 mmHg a 25 ° C.
Punto di ebollizione
131,1 ° C.
Punto di fusione
-117,2 ° C.
punto di accensione
43 ° C (vaso chiuso).
Temperatura di autoaccensione
340 ° C.
Solubilità
È relativamente solubile in acqua: 28g / L. Questo perché le molecole altamente polari nell'acqua non hanno un'affinità speciale per la catena di carbonio dell'alcol isoamilico. Se fossero miscelati si osserverebbero due fasi: una inferiore, corrispondente all'acqua, e una superiore, quella dell'alcool isoamilico..
Al contrario, è molto più solubile in solventi meno polari come: acetone, etere dietilico, cloroformio, etanolo o acido acetico glaciale; e anche in etere di petrolio.
Viscosità
3.738 cP a 25 ° C.
Tensione superficiale
24,77 dine / cm a 15 ° C.
Indice di rifrazione
1,4075 a 20 ° C.
Capacità termica
2.382 kJ / gK.
Applicazioni
Materiale grezzo
Altri esteri, tiofene e farmaci come nitrito di amile, Validol (mentil isovalerato), Bromisoval (bromovalerilurea), Corvalol (un tranquillante della valeriana) e Barbamil (amobarbital) possono essere sintetizzati dall'alcol isoamilico..
Fragranze
Oltre ad essere utilizzato per la sintesi dell'acetato di amile, che ha un aroma di banana, si ottengono anche altre fragranze di frutta come albicocca, arancia, prugna, ciliegia e malto. Pertanto, è un alcol necessario nella produzione di molti prodotti commestibili o cosmetici..
Antischiuma
Riducendo la tensione superficiale, ne promuove l'utilizzo nei sistemi microemulsionati. In pratica, evita la formazione accelerata di bolle, riducendole di dimensione fino a quando non si rompono.
Inoltre aiuta a definire meglio l'interfaccia tra la fase acquosa e quella organica durante le estrazioni; per esempio, si aggiunge fenolo-cloroformio alla miscela dell'estrattore in un rapporto di 25: 24: 1. Questa tecnica è intesa per l'estrazione del DNA.
Estrazioni
L'alcol isoamilico consente anche di estrarre grassi o oli da diversi campioni, ad esempio dal latte. Allo stesso modo, scioglie paraffina, inchiostri, gomme, lacche ed esteri di cellulosa.
Continuando con le estrazioni, è possibile ottenere acido fosforico da soluzioni di nitrato di minerali di fosfato di ferro..
Rischi
Conservazione e reattività
Come ogni liquido che emana odori, può rappresentare un imminente rischio di incendio se il luogo in cui viene immagazzinato alza troppo la temperatura, ancor di più se è già presente una fonte di calore.
In queste condizioni funge semplicemente da combustibile, alimentando le fiamme e facendo esplodere anche il suo contenitore. Quando brucia, rilascia vapori che possono nuocere alla salute e provocare soffocamento.
Altre cause per cui l'alcol isoamilico prende fuoco è mescolarlo o farlo reagire con sostanze come: perclorati, perossidi, bromo, fluoro, idruri metallici, acidi forti, ammine alifatiche, ecc..
Salute
A contatto con la pelle può irritarla e seccarla. I sintomi, tuttavia, sono più gravi se inalati per troppo tempo (tosse, ustioni a naso, gola e polmoni) o se ingeriti (mal di testa, nausea, diarrea, vomito, vertigini e perdita di coscienza).
E infine, quando si riversa negli occhi, li irrita e può persino danneggiarli irreversibilmente. Fortunatamente il suo odore di "pera alcolica" gli permette di essere rilevato in caso di perdita o sversamento; oltre a questo, è un composto che va maneggiato con rispetto.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2019). Alcool isoamilico. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Alcool isoamilico. Database PubChem. CID = 31260. Estratto da: pubchem.ncbi.nlm.nih.gov
- Zhang Yu e Muhammed Mamoun. (17 settembre 2008). Estrazione di acido fosforico da soluzioni di nitrato con alcool isoamilico. Estrazione con solventi e volume di scambio ionico 6, 1988 - Edizione 6. doi.org/10.1080/07366298808917973
- Dipartimento della Salute del New Jersey. (2008). Alcool isoamilico. [PDF]. Estratto da: nj.gov
- Kat Chem. (2019). Alcool isoamilico. Estratto da: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Alcool isoamilico. Estratto da: chemoxy.com



Nessun utente ha ancora commentato questo articolo.