
Struttura, proprietà, usi e rischi della trietilammina
Il trietilammina è un composto organico, più precisamente un'ammina alifatica, la cui formula chimica è N (CHDueCH3)3 o NEt3. Come altre ammine liquide, ha un odore simile a quello dell'ammoniaca mista a pesce; i suoi vapori rendono noioso e pericoloso manipolare questa sostanza senza cappa aspirante o indumenti adeguati.
Oltre alle rispettive formule, questo composto è spesso abbreviato in TEA; tuttavia, questo può portare a confusione con altre ammine, come trietanolammina, N (EtOH)3, o tetraetilammonio, un'ammina quaternaria, NEt4+.

Dal suo scheletro (immagine in alto), si può dire che la trietilammina è abbastanza simile all'ammoniaca; mentre il secondo ha tre idrogeni, NH3, il primo ha tre gruppi etilici, N (CHDueCH3)3. La sua sintesi parte dal trattamento dell'ammoniaca liquida con etanolo, una alchilazione che si verifica.
La rete3 può formare un sale igroscopico con HCl: trietilammina cloridrato, NEt3· HCl. Inoltre, partecipa come catalizzatore omogeneo alla sintesi di esteri e ammidi, rendendolo un solvente necessario nei laboratori organici..
Inoltre, insieme ad altri reagenti, consente l'ossidazione di alcoli primari e secondari rispettivamente in aldeidi e chetoni. Come l'ammoniaca è una base e quindi può formare sali organici attraverso reazioni di neutralizzazione.
Indice articolo
- 1 Struttura della trietilammina
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Punto di ebollizione
- 2.4 Punto di fusione
- 2.5 Densità
- 2.6 Solubilità
- 2.7 Densità del vapore
- 2.8 Pressione di vapore
- 2.9 Costante di Henry
- 2.10 Punto di infiammabilità
- 2.11 Temperatura di autoaccensione
- 2.12 Capacità termica
- 2.13 Calore di combustione
- 2.14 Calore di vaporizzazione
- 2.15 Tensione superficiale
- 2.16 Indice di rifrazione
- 2.17 Viscosità
- 2.18 Costante di basicità
- 2.19 Basicità
- 3 usi
- 3.1 Polimeri
- 3.2 Cromatografia
- 3.3 Prodotti commerciali
- 4 Rischi
- 5 Riferimenti
Struttura della trietilammina
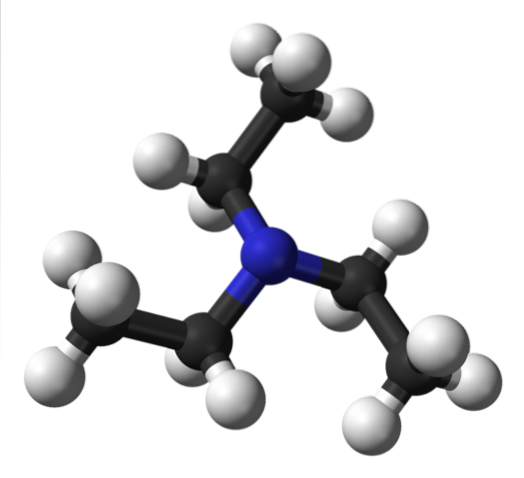
L'immagine in alto mostra la struttura della trietilammina con un modello di sfere e barre. Al centro della molecola c'è l'atomo di azoto, rappresentato da una sfera bluastra; e ad esso collegati, i tre gruppi etilici, come piccoli rami di sfere bianche e nere.
Sebbene non siano visibili ad occhio nudo, sull'atomo di azoto c'è una coppia di elettroni non condivisi. Questi due elettroni e i tre gruppi -CHDueCH3 sperimentano repulsioni elettroniche; ma d'altra parte contribuiscono a definire il momento di dipolo della molecola.
Tuttavia, un tale momento di dipolo è inferiore a quello, ad esempio, di dietilammina, NHEtDue; e allo stesso modo, manca ogni possibilità di formare legami idrogeno.
Questo perché nella trietilammina non c'è legame N-H e, di conseguenza, si osservano punti di fusione e di ebollizione inferiori rispetto ad altre ammine che interagiscono in questo modo..
Sebbene vi sia un leggero momento di dipolo, le forze di dispersione tra i gruppi etilici delle molecole NEt non possono essere escluse.3 vicinato. Sommando questo effetto, è giustificato il motivo per cui, sebbene la trietilammina sia volatile, bolle a circa 89 ° C, grazie alla sua massa molecolare relativamente grande..
Proprietà
Aspetto fisico
Liquido incolore con sgradevole ammoniaca e odore di pesce.
Massa molare
101,193 g / mol.
Punto di ebollizione
89ºC.
Punto di fusione
-115 ° C. Nota quanto sono deboli le forze intermolecolari che legano le molecole di trietilammina nel loro solido.
Densità
0,7255 g / mL.
Solubilità
È relativamente solubile in acqua, 5,5 g / 100 g a 20 ° C. Sotto i 18,7 ºC, secondo Pubchem, è anche miscibile con questo.
Oltre ad "andare d'accordo" con l'acqua, è anche solubile in acetone, benzene, etanolo, etere e paraffina..
Densità del vapore
3,49 in rapporto d'aria.
Pressione del vapore
57,07 mmHg a 25 ° C.
La costante di Henry
66 μmol / Pa Kg.
punto di accensione
-15ºC.
Temperatura di autoaccensione
312ºC.
Capacità termica
216,43 kJ / mol.
Calore di combustione
10.248 cal / g.
Calore di vaporizzazione
34,84 kJ / mol.
Tensione superficiale
20,22 N / ma 25 ° C.
Indice di rifrazione
1.400 a 20ºC.
Viscosità
0,347 mPa · sa 25ºC.
Costante di basicità
La trietilammina ha un pKb pari a 3,25.
Basicità
La basicità di questa ammina può essere espressa dalla seguente equazione chimica:
Netto3 + HA <=> NHEt3+ + PER-
Dove HA è una specie acida debole. La coppia NHEt3+PER- costituisce quello che diventa un sale di ammonio terziario.
Acido coniugato NHEt3+ è più stabile dell'ammonio, NH4+, perché i tre gruppi etilici donano parte della loro densità elettronica per diminuire la carica positiva sull'atomo di azoto; pertanto, la trietilammina è più basica dell'ammoniaca (ma meno basica dell'OH-).
Applicazioni

La basicità, in questo caso, la nucleofilia della trietilammina viene utilizzata per catalizzare la sintesi di estere e ammidi da un substrato comune: un cloruro acilico, RCOCl (immagine in alto).
Qui la coppia libera di elettroni dell'azoto attacca il gruppo carbonile, formando un intermedio; che, consecutivamente, viene attaccato da un alcol o un'ammina per formare rispettivamente un estere o un'ammide.
Nella prima riga dell'immagine viene visualizzato il meccanismo seguito dalla reazione per produrre l'estere, mentre la seconda riga corrisponde all'ammide. Si noti che la trietilammina cloridrato, NEt, viene prodotta in entrambe le reazioni3HCl, da cui si recupera il catalizzatore per avviare un altro ciclo.
Polimeri
La nucleofilia della trietilammina viene anche utilizzata per aggiungere a determinati polimeri, polimerizzandoli e dando loro maggiori masse. Ad esempio, fa parte della sintesi di resine di policarbonato, schiume poliuretaniche e resine epossidiche.
Cromatografia
La sua anfifilicità e volatilità remote consentono di utilizzare i suoi sali derivati come reagenti nella cromatografia a scambio ionico. Un altro uso implicito della trietilammina è che da essa si possono ottenere vari sali di ammina terziaria, come il bicarbonato di trietilammina, NHEt3HCO3 (o TEAB).
Prodotti commerciali
È stato utilizzato come additivo nella formulazione di sigarette e tabacco, conservanti alimentari, detergenti per pavimenti, aromi, pesticidi, coloranti, ecc..
Rischi
I fumi di trietilammina non sono solo sgradevoli ma pericolosi, poiché possono irritare naso, gola e polmoni, provocando edema polmonare o bronchite. Allo stesso modo, essendo più dense e più pesanti dell'aria, rimangono a filo del suolo, spostandosi verso possibili fonti di calore per poi esplodere..
I contenitori di questo liquido dovrebbero essere il più lontano dal fuoco perché rappresentano un pericolo imminente di esplosione..
Inoltre, dovrebbe essere evitato il suo contatto con specie o reagenti come: metalli alcalini, acido tricloroacetico, nitrati, acido nitrico (poiché formerebbe nitrosoammine, composti cancerogeni), acidi forti, perossidi e permanganati..
Non deve toccare l'alluminio, il rame, lo zinco o le loro leghe, poiché ha la capacità di corroderli.
Per quanto riguarda il contatto fisico, può provocare allergie ed eruzioni cutanee se l'esposizione è acuta. Oltre ai polmoni, può influenzare il fegato e i reni. E per quanto riguarda il contatto con gli occhi, provoca irritazione, che potrebbe persino danneggiare gli occhi se non vengono trattati o puliti in tempo..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2019). Trietilammina. Estratto da: en.wikipedia.org
- Merck. (2019). Trietilammina. Estratto da: sigmaaldrich.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Trietilammina. Database PubChem. CID = 8471. Estratto da: pubchem.ncbi.nlm.nih.gov
- Rete di dati sulla tossicologia. (s.f.). Trietilammina. Recupero da: toxnet.nlm.nih.gov
- Dipartimento della Salute del New Jersey. (2010). Trietilammina. Estratto da: nj.gov



Nessun utente ha ancora commentato questo articolo.