
Fattori di cinetica chimica, ordine di reazione e applicazioni
Il cinetica chimica È lo studio delle velocità di una reazione. Dedurre dati sperimentali o teorici sul meccanismo molecolare, attraverso leggi espresse da equazioni matematiche. I meccanismi sono costituiti da una serie di passaggi, alcuni dei quali sono veloci e altri sono lenti..
Il più lento di questi è chiamato il passo che determina la velocità. Pertanto, conoscere le specie intermedie e il meccanismo di funzionamento di questo passaggio è molto importante in termini cinetici. Una visualizzazione di quanto sopra è supporre che i reagenti siano racchiusi in una bottiglia e che, reagendo, i prodotti fuoriescano verso l'esterno.

Infine, i prodotti fuoriescono liberamente dalla bocca della bottiglia senza ulteriori impedimenti cinetici. Da questo punto di vista, ci sono bottiglie di molte dimensioni e design. Tuttavia, hanno tutti un elemento in comune: un collo stretto, indicatore del passo decisivo della reazione..
Indice articolo
- 1 Cosa studia la cinetica chimica?
- 2 Velocità di reazione
- 2.1 Definizione
- 2.2 Equazione generale
- 2.3 Esempio di dessert
- 2.4 Come determinarlo
- 3 fattori che influenzano la velocità di reazione
- 3.1 Natura delle specie chimiche
- 3.2 Concentrazione dei reagenti
- 3.3 Temperatura
- 4 Ordine di reazione nella cinetica chimica
- 4.1 Reazioni di ordine zero
- 4.2 Reazione del primo ordine
- 4.3 Reazione del secondo ordine
- 4.4 Ordine di reazione vs molecolarità
- 5 Applicazioni
- 6 Riferimenti
Cosa studia la cinetica chimica?
Sperimentalmente, questa branca della chimica studia le variazioni di concentrazione coinvolte in una reazione chimica, dalla misurazione di una specifica proprietà.
La cinetica chimica è la branca della chimica incaricata di studiare tutte le informazioni che possono essere ricavate dalla velocità di una reazione. Il suo nome invita a immaginare un orologio da tasca che segna il tempo di un processo, indipendentemente da dove si verifica: in un reattore, in una nuvola, in un fiume, nel corpo umano, ecc..
Tutte le reazioni chimiche, e quindi tutte le trasformazioni, hanno aspetti termodinamici, di equilibrio e cinetici. La termodinamica indica se una reazione è spontanea o meno; l'equilibrio il suo grado di quantificazione; e cinetica le condizioni che ne favoriscono la velocità e anche i dati sul suo meccanismo.
Molti degli aspetti essenziali della cinetica chimica si possono osservare nella vita quotidiana: nel frigorifero, che congela gli alimenti per ridurne la decomposizione congelando l'acqua che ne fa parte. Inoltre, nella maturazione dei vini, il cui affinamento gli conferisce i suoi piacevoli sapori.
Tuttavia, "il tempo delle molecole" è molto diverso nelle sue piccole scale e varia enormemente in base a molti fattori (numero e tipo di legami, dimensioni, stati della materia, ecc.).
Poiché il tempo è vita, ed è anche denaro, sapere quali variabili consentono a una reazione chimica di procedere il più rapidamente possibile è della massima importanza. Tuttavia, a volte si desidera il contrario: che la reazione avvenga molto lentamente, soprattutto se è esotermica e ci sono rischi di esplosione.
Quali sono queste variabili? Alcuni sono fisici, come a quale pressione o temperatura dovrebbe avere un reattore o un sistema; e altri sono chimici, come il tipo di solvente, pH, salinità, struttura molecolare, ecc..
Tuttavia, prima di trovare queste variabili, dobbiamo prima studiare la cinetica della presente reazione.
Come? Attraverso la variazione di concentrazione, che può essere seguita se si quantifica una particolare proprietà proporzionale alla prima. Nel corso della storia, i metodi sono diventati più sofisticati, consentendo misurazioni più accurate e precise e con intervalli sempre più brevi..
Velocità di reazione
Per determinare la velocità di una reazione chimica, è necessario sapere come varia la concentrazione nel tempo di una qualsiasi delle specie coinvolte. Questa velocità dipende in larga misura da molti fattori, ma la cosa più importante è che sia misurabile per quelle reazioni che avvengono "lentamente".
Qui la parola "lentamente" è relativa ed è definita per tutto ciò che può essere misurato con le tecniche strumentali disponibili. Se, ad esempio, la reazione è molto più veloce della capacità di misurazione dell'apparecchiatura, allora non sarà quantitativa né sarà possibile studiarne la cinetica..
Quindi, la velocità di reazione viene determinata alla soglia di qualsiasi processo prima che raggiunga l'equilibrio. Perché? Perché in equilibrio la velocità della reazione diretta (formazione del prodotto) e quella della reazione inversa (formazione del reagente) sono le stesse.
Controllando le variabili che agiscono sul sistema e, di conseguenza, la sua cinetica o la velocità di reazione, si possono scegliere le condizioni ideali per generare una certa quantità di prodotto nel tempo più desiderato e sicuro..
D'altra parte, questa conoscenza rivela il meccanismo molecolare, che è prezioso quando si aumenta la resa di una reazione..
Definizione
La velocità è il cambiamento di una grandezza in funzione del tempo. Per questi studi l'interesse sta nel determinare la variazione della concentrazione con il passare delle ore e dei minuti; nano, pico o anche femtosecondi (10-quindiciS).
Puoi avere molte unità, ma la più semplice e facile di tutte è M s-1, o ciò che è uguale a mol / L · s. Indipendentemente dalle sue unità, dovrebbe sempre avere un valore positivo, poiché è una quantità fisica (come dimensioni o massa).
Tuttavia, per convenzione, i tassi di scomparsa di un reagente hanno un segno negativo e quelli di comparsa di un prodotto hanno un segno positivo..
Ma se i reagenti e i prodotti hanno le proprie velocità, come determinare la velocità di reazione complessiva? La risposta è nei coefficienti stechiometrici.
Equazione generale
La seguente equazione chimica esprime la reazione di A e B per formare C e D:
perPER + bB => cC + dD
Le concentrazioni molari sono solitamente espresse tra parentesi quadre, quindi, ad esempio, la concentrazione della specie A è scritta come [A]. Pertanto, la velocità di reazione per ciascuna delle specie chimiche coinvolte è:
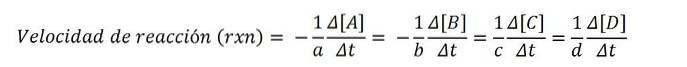
Secondo l'equazione matematica, ci sono quattro percorsi per raggiungere la velocità di reazione: viene misurata la variazione di concentrazione di uno qualsiasi dei reagenti (A o B) o dei prodotti (C o D)..
Quindi, con uno di questi valori, e il suo coefficiente stechiometrico corretto, dividere per quest'ultimo e ottenere la velocità di reazione rxn.
Poiché la velocità di reazione è una quantità positiva, il segno negativo moltiplica i valori di velocità negativa dei reagenti; per questo motivo i coefficienti per Y b moltiplicare per (-1).
Ad esempio, se il tasso di scomparsa di A è - (5M / s) e il suo coefficiente stechiometrico per è 2, quindi la velocità rxn è uguale a 2,5 M / s ((-1/2) x 5).
Esempio di dessert

Se il prodotto fosse un dolce, gli ingredienti per analogia sarebbero i reagenti; e l'equazione chimica, la ricetta:
7Biscotti + 3 Brownies + 1 Gelato => 1 Dessert
E le velocità per ciascuno degli ingredienti dolci e per il dessert stesso sono:
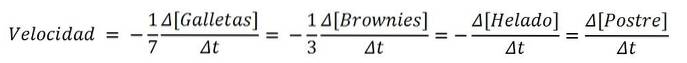
Pertanto, la velocità con cui viene realizzato il dolce può essere determinata con la variazione dei biscotti, dei brownies, del gelato o del set stesso; poi dividendolo per i suoi coefficienti stechiometrici (7, 3, 1 e 1). Tuttavia, uno dei percorsi potrebbe essere più facile dell'altro..
Ad esempio, se si misura il modo in cui [Dessert] aumenta a diversi intervalli di tempo, queste misurazioni possono essere difficili..
D'altra parte, può essere più comodo e pratico misurare i [Biscotti], a causa del loro numero o di alcune delle loro proprietà che rendono la loro concentrazione più facile da determinare rispetto a quella dei brownies o del gelato..
Come determinarlo
Data la semplice reazione A => B, se A, ad esempio, in soluzione acquosa, mostra una colorazione verde, allora questo dipende dalla sua concentrazione. Quindi, quando A diventa B, il colore verde scompare e se questa scomparsa viene quantificata, si può ottenere una curva di [A] vs t.
Se invece B è una specie acida, il pH della soluzione scenderà a valori inferiori a 7. Quindi, dalla diminuzione del pH si ottiene [B], e consecutivamente, il grafico [B] vs t. Quindi sovrapponendo entrambi i grafici possiamo vedere qualcosa di simile a quanto segue:

Nel grafico possiamo vedere come [A] diminuisce nel tempo, perché si consuma, e come la curva [B] aumenta con una pendenza positiva perché è il prodotto.
Si può anche vedere che [A] tende a zero (se non c'è equilibrio) e che [B] raggiunge un valore massimo governato dalla stechiometria e se la reazione è completa (tutto A si consuma).
La velocità di reazione di A e B è la linea tangente su una di queste curve; in altre parole, la derivata.
Fattori che influenzano la velocità di reazione
Natura delle specie chimiche
Se tutte le reazioni chimiche fossero istantanee, i loro studi cinetici non esisterebbero. Molti hanno velocità così elevate che non possono essere misurate; cioè non sono misurabili.
Pertanto, le reazioni tra gli ioni sono generalmente molto rapide e complete (con una resa intorno al 100%). D'altra parte, quelli che coinvolgono composti organici richiedono un po 'di tempo. Una reazione del primo tipo è:
HDueSW4 + 2NaOH => NaDueSW4 + 2HDueO
Le forti interazioni elettrostatiche tra gli ioni favoriscono la rapida formazione di acqua e solfato di sodio. Una reazione del secondo tipo è invece, ad esempio, l'esterificazione dell'acido acetico:
CH3COOH + CH3CHDueOH => CH3COOCHDueCH3 + HDueO
Sebbene si formi anche acqua, la reazione non è istantanea; anche in condizioni favorevoli, ci vogliono diverse ore per completare.
Tuttavia, altre variabili hanno più influenza sulla velocità della reazione: concentrazione di reagenti, temperatura, pressione e presenza di catalizzatori..
Concentrazione del reagente
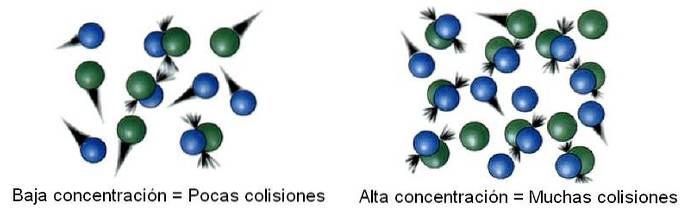
Nella cinetica chimica lo spazio in esame, separato dall'infinito, è chiamato sistema. Ad esempio, un reattore, un becher, un pallone, una nuvola, una stella, ecc. Possono essere considerati come il sistema in esame..
Pertanto, all'interno del sistema le molecole non sono statiche ma piuttosto "viaggiano" in tutti i suoi angoli. In alcuni di questi spostamenti, si scontra con un'altra molecola per riprendersi o produrre prodotti..
Quindi, il numero di collisioni è proporzionale alla concentrazione dei reagenti. L'immagine sopra mostra come il sistema passa da concentrazioni basse ad alte.
Inoltre, più collisioni ci sono, più veloce è la velocità di reazione, poiché aumentano le possibilità che due molecole reagiscano..
Se i reagenti sono gassosi, la variabile di pressione viene gestita ed è correlata alla concentrazione di gas assumendo una qualsiasi delle molte equazioni esistenti (come quella del gas ideale); o anche, il volume del sistema viene ridotto per aumentare le possibilità che le molecole gassose entrino in collisione.
Temperatura
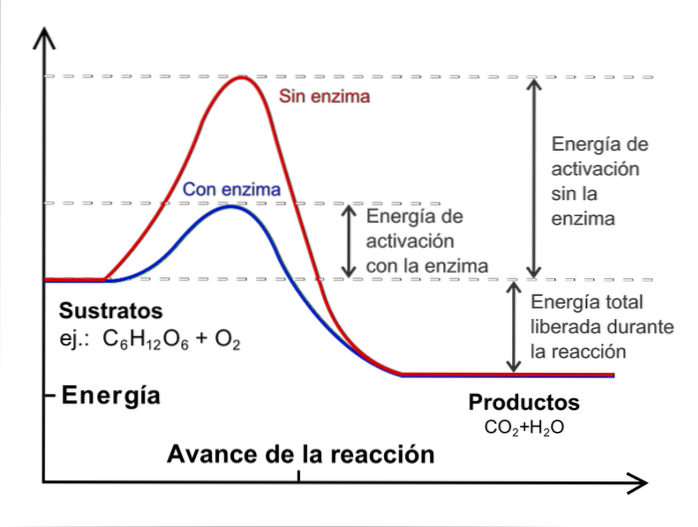
Sebbene il numero di collisioni aumenti, non tutte le molecole hanno l'energia necessaria per superare l'energia di attivazione del processo.
È qui che la temperatura gioca un ruolo importante: svolge la funzione di accelerare termicamente le molecole in modo che si scontrino con più energia..
Pertanto, la velocità di reazione generalmente raddoppia per ogni aumento di 10 ° C della temperatura del sistema. Tuttavia, per tutte le reazioni questo non è sempre il caso. Come prevedere questo aumento? L'equazione di Arrhenius risponde alla domanda:
d (lnK) / dT = E / (RTDue)
K è la costante di velocità alla temperatura T, R è la costante dei gas ed E è l'energia di attivazione. Questa energia è indicativa della barriera energetica che i reagenti devono scalare per reagire..
Per effettuare uno studio cinetico è necessario mantenere la temperatura costante e senza catalizzatori. Cosa sono i catalizzatori? Sono specie esterne che intervengono nella reazione ma senza essere consumate e che diminuiscono l'energia di attivazione.
L'immagine sopra illustra il concetto di catalisi per la reazione del glucosio con l'ossigeno. La linea rossa rappresenta l'energia di attivazione senza l'enzima (catalizzatore biologico), mentre con essa la linea blu mostra una diminuzione dell'energia di attivazione.
Ordine di reazione nella cinetica chimica
In un'equazione chimica, gli indici stechiometrici, relativi al meccanismo di reazione, non sono uguali agli indici dello stesso ordine. Le reazioni chimiche di solito hanno il primo o il secondo ordine, raramente il terzo o superiore..
Per cosa è questo? Perché le collisioni di tre molecole eccitate energeticamente sono improbabili, e ancora di più sono collisioni quadruple o quintuple, dove la probabilità è infinitesimale. Sono possibili anche ordini di reazione frazionata. Per esempio:
NH4Cl <=>NH3 + HCl
La reazione è del primo ordine in un senso (da sinistra a destra) e del secondo ordine nell'altro (da destra a sinistra) se è considerato un equilibrio. Mentre il seguente equilibrio è del secondo ordine in entrambe le direzioni:
2HI <=> HDue + ioDue
La molecolarità e l'ordine di reazione sono gli stessi? No. La molecolarità è il numero di molecole che reagiscono per dare origine ai prodotti e l'ordine di reazione complessivo è lo stesso ordine dei reagenti coinvolti nella fase di determinazione della velocità..
2KMnO4 + 10KI + 8HDueSW4 => 2MnSO4 + 5IDue + 6KDueSW4 + 8HDueO
Questa reazione, nonostante abbia alti indici stechiometrici (molecolarità), è in realtà una reazione del secondo ordine. In altre parole, il passo determinante della velocità è del secondo ordine.
Reazioni di ordine zero
Si verificano per il caso di reazioni eterogenee. Ad esempio: tra un liquido e un solido. Pertanto, la velocità è indipendente dalle concentrazioni dei reagenti.
Allo stesso modo, se un reagente ha un ordine di reazione pari a zero, significa che non partecipa alla fase determinante della velocità, ma al rapido.
Reazione del primo ordine
A => B
Una reazione di primo ordine è regolata dalla seguente legge sui tassi:
V = k [A]
Se la concentrazione di A raddoppia, la velocità di reazione V raddoppia. Pertanto, la velocità è proporzionale alla concentrazione del reagente nella fase di determinazione della reazione..
Reazione di secondo ordine
2A => B
A + B => C
Due specie sono coinvolte in questo tipo di reazione, proprio come nelle due equazioni chimiche appena scritte. Le leggi di velocità per le reazioni sono:
V = k [A]Due
V = k [A] [B]
Nella prima la velocità di reazione è proporzionale al quadrato della concentrazione di A, mentre nella seconda avviene lo stesso delle reazioni del primo ordine: la velocità è direttamente proporzionale alle concentrazioni sia di A che di B.
Ordine di reazione vs molecolarità
Secondo l'esempio precedente, i coefficienti stechiometrici possono o non possono coincidere con gli ordini di reazione.
Tuttavia, questo accade per le reazioni elementari, che determinano il meccanismo molecolare di ogni fase di una reazione. In queste reazioni i coefficienti sono uguali al numero di molecole partecipanti.
Ad esempio, una molecola di A reagisce con una di B per formare una molecola di C.Qui la molecolarità è 1 per i reagenti e quindi nell'espressione della legge di velocità coincidono con gli ordini di reazione.
Da ciò ne consegue che la molecolarità deve essere sempre un numero intero e, probabilisticamente, minore di quattro.
Perché? Perché al passaggio di un meccanismo è molto improbabile che quattro molecole partecipino contemporaneamente; due di loro potrebbero reagire prima, e poi i restanti due reagirebbero con questo prodotto.
Matematicamente questa è una delle principali differenze tra ordini di reazione e molecolarità: un ordine di reazione può assumere valori frazionari (1/2, 5/2, ecc.).
Questo perché il primo riflette solo il modo in cui la concentrazione della specie influisce sulla velocità, ma non il modo in cui le loro molecole intervengono nel processo..
Applicazioni
- Permette di determinare il tempo in cui un farmaco rimane nell'organismo prima del suo completo metabolismo. Allo stesso modo, grazie agli studi cinetici, la catalisi enzimatica può essere seguita come metodi verdi rispetto ad altri catalizzatori con impatti ambientali negativi; o anche per essere utilizzato in innumerevoli processi industriali.
- Nell'industria automobilistica, in particolare nei motori, dove le reazioni elettrochimiche devono essere eseguite rapidamente affinché il veicolo possa avviarsi. Anche nei suoi tubi di scarico, che hanno convertitori catalitici per trasformare i gas nocivi CO, NO e NO.X in CODue, HDueSOPRADue meDue durante il tempo ottimale.
2NaN3(s) = 2Na (s) + 3NDue(g)
-È la reazione alla base del motivo per cui gli airbag, gli "airbag", si gonfiano quando i veicoli entrano in collisione. Quando le gomme sbattono sui freni, un rilevatore fa esplodere elettricamente l'azoturo di sodio, NaN3. Questo reagente "esplode" rilasciando NDue, che occupa velocemente l'intero volume della borsa.
Il sodio metallico reagisce quindi con altri componenti per neutralizzarlo, perché allo stato puro è velenoso.
Riferimenti
- Walter J. Moore. (1963). Chimica fisica. Nel Cinetica chimica. Quarta edizione, Longmans.
- Ira N. Levine. (2009). Principi di fisicochimica. Sesta edizione, pp. 479-540. Mc Graw Hill.
- UAwiki. (23 dicembre 2011). Le collisioni molecolari sono. [Figura]. Estratto il 30 aprile 2018 da: es.m.wikipedia.org
- Glasstone. (1970). Libro di testo di chimica fisica. Nel Cinetica chimica. Seconda edizione. D. Van Nostrand, Company, Inc.
- Anne Marie Helmenstine, Ph.D. (8 marzo 2017). Definizione di cinetica chimica. Estratto il 30 aprile 2018 da: thoughtco.com
- Khan Academy. (2018). Tassi di reazione e leggi di velocità. Estratto il 30 aprile 2018 da: khanacademy.org
- Germán Fernández. (26 luglio 2010). Cinetica chimica. Estratto il 30 aprile 2018 da: quimicafisica.com



Nessun utente ha ancora commentato questo articolo.