
Proprietà, reattività, rischi, usi dell'idruro di sodio (NaH)

Il idruro di sodio È un composto inorganico di formula NaH. Ha un legame ionico tra sodio e idruro. La sua struttura è illustrata nella figura 1. È rappresentativa degli idruri salini, il che significa che è un idruro simile al sale, composto da ioni Na + e H-, a differenza di più idruri molecolari come borano, metano, ammoniaca e acqua.
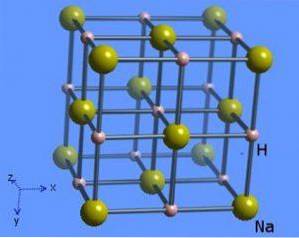
La struttura cristallina ha un numero di coordinazione 6, dove ogni molecola di sodio è circondata da 8 ioni idruro che presentano una forma ottaedrica ed è illustrata nella figura 2 (Mark Winter [The University of Sheffield and WebElements Ltd, 1993-2016).
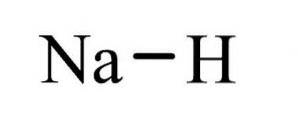
Il composto viene preparato dalla reazione diretta tra sodio e idrogeno gassoso (Formula di idruro di sodio - Usi, proprietà, struttura e formula di idruro di sodio, 2005-2017) come segue:
H2 + 2Na → 2NaH
L'idruro di sodio è venduto commercialmente come forma di dispersione al 60% p / p (percentuale peso su peso) in olio minerale per una manipolazione sicura (IDRURO DI SODIO, n.d.).
Indice articolo
- 1 Proprietà fisiche e chimiche dell'idruro di sodio
- 2 Reattività e pericoli
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche dell'idruro di sodio
L'idruro di sodio è un solido bianco quando è puro, sebbene sia generalmente di colore grigio o argento. Il suo aspetto è mostrato nella figura 3.

NaH ha un peso molecolare di 23,99771 g / mol, una densità di 1,396 g / ml e un punto di fusione di 800 ° C (Royal Society of Chemistry, 2015). È insolubile in ammoniaca, benzene, tetracloruro di carbonio e disolfuro di carbonio (National Center for Biotechnology Information, n.d.).
Il composto è estremamente instabile. Il NaH puro può facilmente infiammarsi nell'aria. A contatto con l'acqua presente nell'aria rilascia idrogeno altamente infiammabile.
Quando è aperto all'aria e all'umidità, il NaH si idrolizza facilmente nella forte base corrosiva dell'idrossido di sodio (NaOH) in base alla reazione:
NaH + H2O → NaOH + H2
In questa reazione si può vedere che l'idruro di sodio si comporta come una base. Ciò è dovuto all'elettronegatività.
Il sodio ha un'elettronegatività significativamente inferiore (≈1,0) rispetto all'idrogeno (≈2,1), il che significa che l'idrogeno attira la densità elettronica verso se stesso, allontanandosi dal sodio per generare un catione di sodio e un idruro di anione.
Affinché un composto sia un acido di Brønsted, è necessario separare la densità elettronica dell'idrogeno, ovvero collegarlo a un atomo elettronegativo come ossigeno, fluoro, azoto, ecc. Solo allora, può essere formalmente descritto come H + e può essere dissociato come tale.
Un idruro è molto meglio descritto come H- e ha una coppia di elettroni liberi. In quanto tale, è una base di Brønsted, non un acido. In effetti, se estendi la definizione di acido / base di Brønsted come fece Lewis, arriverai alla conclusione che il sodio (Na +) è la specie acida qui..
Il prodotto di reazione acido / base di Brønsted della base H- e acido H + diventa H2. Poiché l'idrogeno acido viene estratto direttamente dall'acqua, l'idrogeno gassoso può ribollire, spostando l'equilibrio anche se la reazione non è termodinamicamente favorita..
Gli ioni OH possono rimanere che possono essere scritti con il resto del catione Na + per dare idrossido di sodio (Perché l'idruro di sodio solido è una base e non un acido quando reagisce con l'acqua?, 2016).
Reattività e rischi
Il composto è un potente agente riducente. Attacca SiO2 nel vetro. Si accende a contatto con i gassosi F2, Cl2, Br2 e I2 (quest'ultimo a temperature superiori a 100 ° C), soprattutto in presenza di umidità, formando HF, HCl, HBr e HI.
Reagisce con lo zolfo dando Na2S e H2S. Può reagire in modo esplosivo con dimetilsolfossido. Reagisce vigorosamente con l'acetilene, anche a -60 ° C. È spontaneamente infiammabile al fluoro.
Inizia una reazione di polimerizzazione in etil-2,2,3-trifluoropropionato, in modo tale che l'estere si decomponga violentemente. La presenza nella reazione di dietil succinato e etil trifluoroacetato ha causato esplosioni (SODIUM HYDRIDE, 2016).
L'idruro di sodio è considerato corrosivo per la pelle o gli occhi, a causa del potenziale rischio di sottoprodotti caustici delle reazioni con l'acqua..
In caso di contatto con gli occhi, questi devono essere risciacquati con abbondanti quantità di acqua, sotto le palpebre per almeno 15 minuti e consultare immediatamente un medico..
In caso di contatto con la pelle, spazzolare immediatamente e sciacquare la zona interessata con acqua. Rivolgiti a un medico se l'irritazione persiste..
Nocivo se ingerito a causa della reazione all'acqua. Non provoca il vomito. Rivolgersi immediatamente a un medico e trasferire la vittima in una struttura medica..
La dispersione di olio di idruro di sodio non è polvere. Tuttavia, il materiale reagente può emettere una sottile nebbia caustica. In caso di inalazione, sciacquare la bocca con acqua e portare la vittima all'aria aperta. Cercare assistenza medica (Rhom and Hass inc., 2007).
Applicazioni
L'utilizzo principale dell'idruro di sodio è quello di effettuare reazioni di condensazione e alchilazione che si sviluppano attraverso la formazione di un carbanione (catalizzato dalla base).
L'idruro di sodio nell'olio assomiglia agli alcolati di sodio e metalli di sodio nella sua capacità di funzionare come agente deprotonante in estere acetoacetico, condensazioni di Claisen, Stobbe, Dieckmann e altre reazioni correlate. Presenta notevoli vantaggi rispetto ad altri agenti di condensazione in quanto:
- È una base più forte, che si traduce in una deprotonazione più diretta.
- Non è necessario alcun eccesso.
- L'H2 prodotto fornisce una misura dell'entità della reazione.
- Le reazioni collaterali come le riduzioni vengono eliminate.
Le alchilazioni di ammine aromatiche ed eterocicliche come 2-amminopiridina e fenotiazina sono facilmente ottenibili con resa elevata usando miscele di toluene-metilformammide. La concentrazione di dimetilformammide è una variabile utilizzata per controllare la velocità di reazione (HINCKLEY, 1957).
L'uso dell'idruro di sodio è stato proposto per lo stoccaggio dell'idrogeno per l'uso in veicoli a celle a combustibile, l'idruro essendo racchiuso in granuli di plastica che vengono frantumati in presenza di acqua per rilasciare l'idrogeno..
Riferimenti
- HINCKLEY, M. D. (1957). Produzione, manipolazione e usi dell'idruro di sodio. Advances in Chemistry, Vol.19, 106-117.
- Mark Winter [Università di Sheffield e WebElements Ltd, U. (1993-2016). Sodio: idruro di sodio. Estratto da WebElements: webelements.com.
- Centro nazionale per le informazioni sulla biotecnologia. (s.f.). Database composto di PubChem; CID = 24758. Estratto da PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass inc. (2007, dicembre). Sodio idruro 60% di dispersione in olio. Estratto da dow.com.
- Royal Society of Chemistry. (2015). Idruro di sodio. Estratto da ChemSpider: chemspider.com.
- IDRURO DI SODIO. (2016). Estratto da cameochemicals: cameochemicals.noaa.gov.
- Formula di idruro di sodio - Usi, proprietà, struttura e formula di idruro di sodio. (2005-2017). Estratto da Softschools.com: softschools.com.
- IDRURO DI SODIO. (s.f.). Estratto da chemicalland21: chemicalland21.com.
- Perché l'idruro di sodio solido è una base e non un acido quando reagisce con l'acqua? (2016, 20 aprile). Estratto da stackexchange: chemistry.stackexchange.com.


Nessun utente ha ancora commentato questo articolo.