
Struttura, proprietà, usi, tossicità del diclorometano
Il diclorometano, noto anche come cloruro di metilene, è un composto organico la cui formula chimica è CHDueClDue. Nello specifico, è un alogenuro alchilico derivato dal gas metano. A differenza del metano, questo composto è un liquido polare incolore.
Fu inizialmente sintetizzato nel 1839 dal chimico e fisico francese Henri Victor Regnault (1810-1878), che riuscì a isolarlo da una miscela di cloro e clorometano esposta alla luce solare..

Il diclorometano viene prodotto industrialmente trattando metano o clorometano con cloro gassoso a temperature elevate (400-500 ºC). Insieme al diclorometano, nel processo vengono prodotti cloroformio e tetracloruro di carbonio, che vengono separati per distillazione..
Il diclorometano viene utilizzato come solvente che consente la saldatura di materie plastiche e per sgrassare i metalli. Viene utilizzato anche nella decaffeinizzazione di caffè e tè, oltre che come estrattore di luppolo e diluente per additivi coloranti e inchiostri per marcare i frutti.
Il diclorometano è un composto tossico che può causare irritazione delle vie nasali e della gola per inalazione. Sono stati riportati danni al fegato in lavoratori esposti ad alte concentrazioni di diclorometano. Inoltre, è un agente mutageno, essendo sospettato di essere cancerogeno.
Indice articolo
- 1 Struttura
- 2 Proprietà
- 2.1 Aspetto
- 2.2 Massa molare
- 2.3 Odore
- 2.4 Soglia di odore
- 2.5 Densità
- 2.6 Punto di fusione
- 2.7 Punto di ebollizione
- 2.8 Solubilità in acqua
- 2.9 Solubilità in altri solventi
- 2.10 Coefficiente di ripartizione ottanolo / acqua
- 2.11 Pressione di vapore
- 2.12 Densità del vapore
- 2.13 Indice di rifrazione (πD)
- 2.14 Viscosità
- 2.15 Punto di infiammabilità
- 2.16 Temperatura di autoaccensione
- 2.17 Stabilità
- 2.18 Decomposizione
- 2.19 Corrosione
- 2.20 Calore di vaporizzazione
- 2.21 Tensione superficiale
- 2.22 Reattività
- 3 usi
- 3.1 Lavorazione alimentare
- 3.2 Industria farmaceutica
- 3.3 Fotografia
- 3.4 Industria elettronica
- 3.5 Dipinti
- 3.6 Trasporto
- 3.7 Altri usi
- 4 Tossicità
- 4.1 Effetti acuti
- 4.2 Effetti cronici
- 5 Riferimenti
Struttura
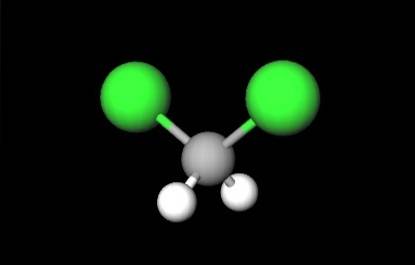
La prima immagine mostrava la formula strutturale di CHDueClDue, in cui risaltano i loro legami covalenti C-H e C-Cl. In alto ha anche la sua struttura rappresentata da un modello di sfere e barre. Si noti ad occhio nudo che i legami C-H (sfere bianche) sono corti, mentre i legami C-Cl (sfere verdi) sono lunghi.
La geometria del CHDueClDue è tetraedrico; ma distorta dagli atomi di cloro più voluminosi. Un'estremità del tetraedro è definita dai due atomi di cloro, più elettronegativi di quelli dell'idrogeno e del carbonio. Quindi, nella molecola CHDueClDue viene stabilito un momento di dipolo permanente (1.6D).
Ciò consente alle molecole di diclorometano di interagire tra loro tramite forze dipolo-dipolo. Allo stesso modo, queste interazioni intermolecolari sono responsabili del fatto che questo composto esiste come liquido nonostante la sua bassa massa molecolare; un liquido che, però, è abbastanza volatile.
Proprietà
Aspetto
Liquido incolore.
Massa molare
84,93 g / mol.
Odore
Dolce, simile al cloroformio.
Soglia di odore
205-307 ppm.
Densità
1.3266 g / cm3 (20 ºC).
Punto di fusione
- 97,6 ºC.
Punto di ebollizione
39,6 ºC.
Solubilità dell'acqua
25,6 g / L a 15 ° C e 5,2 g / L a 60 ° C.
Il diclorometano è appena solubile in acqua. Sebbene entrambe le molecole, CHDueClDue e H.DueOppure sono polari, le loro interazioni sono inefficienti, forse a causa della repulsione tra gli atomi di cloro e ossigeno.
Solubilità in altri solventi
Miscibile con acetato di etile, alcool, esano, benzene, tetracloruro di carbonio, etere dietilico, cloroformio e dimetilformammide.
Coefficiente di ripartizione ottanolo / acqua
Log P = 1,19.
Pressione del vapore
57,3 kPa (25 ° C). Questa pressione corrisponde a circa 5,66 atm, riflettendo un'elevata pressione di vapore..
Densità del vapore
2,93 rispetto all'aria presa come 1.
Indice di rifrazione (πD)
1.4244 (20 ºC).
Viscosità
0,413 cP (25 ° C).
punto di accensione
Il diclorometano non è infiammabile, ma se miscelato con aria forma vapori infiammabili al di sopra di 100ºC..
Temperatura di autoaccensione
556 ºC.
Stabilità
È stabile a temperatura ambiente in assenza di umidità, avendo una relativa stabilità rispetto ai suoi congeneri: cloroformio e tetracloruro di carbonio..
Tende a carbonizzare ad alte temperature (300-450 ºC), quando i suoi vapori entrano in contatto con acciaio e cloruri metallici.
Decomposizione
Può decomporsi a contatto con superfici calde o fiamme, emettendo fumi tossici e irritanti di fosgene e acido cloridrico..
Corrosione
Il diclorometano attacca alcune forme di plastica, gomme e rivestimenti.
Calore di vaporizzazione
28,82 kJ / mol a 25 ºC.
Tensione superficiale
28,20 dine / cm a 25 ºC.
Reattività
Il diclorometano reagisce fortemente con i metalli attivi, come il potassio, il sodio e il litio. Reagisce con basi forti, ad esempio terz-butossido di potassio. È incompatibile con sostanze caustiche, ossidanti e metalli chimicamente attivi.
Inoltre, reagisce con l'ossigeno liquido nelle leghe di sodio e di potassio e con il tetrossido di azoto. A contatto con l'acqua può corrodere alcuni acciai inossidabili, nichel, rame e ferro.
Applicazioni
La maggior parte degli usi e delle applicazioni del diclorometano si basa sulle sue proprietà come solvente. A causa di questa caratteristica, il diclorometano viene utilizzato nell'industria alimentare, dei trasporti, della produzione di medicinali, ecc..
Trasformazione dei prodotti alimentari
Il diclorometano è utilizzato nella decaffeinizzazione dei chicchi di caffè e delle foglie di tè. Viene anche utilizzato per l'estrazione del luppolo per birra, bevande e altri aromi per alimenti, oltre che per la lavorazione delle spezie..
Industria farmaceutica
Il diclorometano è utilizzato per la preparazione di cefalosporina e ampicillina, oltre alla produzione di antibiotici, steroidi e vitamine.
Fotografia
Viene anche utilizzato come solvente nella produzione di triacetato di cellulosa (CTA), utilizzato nella realizzazione di pellicole di sicurezza.
Industria elettronica
È un composto ideale per la produzione di circuiti stampati, utilizzato per sgrassare la superficie in alluminio prima di aggiungere lo strato di fotoresist alla scheda.
Vernici
Il diclorometano è un solvente presente nelle vernici e nei separatori di vernici, utilizzato per rimuovere vernici o rivestimenti di vernice da vari tipi di superfici..
Trasporto
Viene utilizzato per sgrassare parti metalliche e superfici presenti nelle apparecchiature ferroviarie, nonché nei componenti degli aeromobili.
Altri usi
È usato come propellente spray (aerosol) e come agente espandente per schiuma di poliuretano. Viene anche usato come fluido in alcuni tipi di luci natalizie.
Tossicità
Effetti acuti
L'inalazione di diclorometano può causare irritazione delle vie aeree superiori, tosse, respiro sibilante o mancanza di respiro..
Può causare arrossamento della pelle e, se il composto rimane su di essa per lungo tempo, provocare ustioni chimiche. A contatto con gli occhi, il diclorometano produce una grave irritazione che può estendersi a un'ustione.
Inoltre, agisce come una neurotossina generando disturbi visivi, uditivi e psicomotori; ma questi effetti sono reversibili quando si interrompe l'inalazione di diclorometano.
Effetti cronici
Il diclorometano può influenzare il sistema nervoso centrale, causando mal di testa, confusione mentale, nausea, vomito e perdita di memoria..
Negli animali produce effetti nocivi su fegato, reni, sistema nervoso centrale e sistema cardiovascolare.
Per quanto riguarda la cancerogenesi, non è stato segnalato alcun aumento significativo dei decessi per cancro nei lavoratori esposti al diclorometano. Tuttavia, studi su animali hanno mostrato un aumento attribuibile al diclorometano nell'incidenza di cancro al fegato e ai polmoni, oltre a tumori benigni delle ghiandole mammarie..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5ta Edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. (10th edizione.). Wiley plus.
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Diclorometano. Database PubChem., CID = 6344. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Diclorometano. Estratto da: en.wikipedia.org
- Brumer. (14 luglio 2018). Diclorometano. Estratto da: brumer.com
- MSDS in linea. (2019). Pericoli e informazioni sulla sicurezza del diclorometano (cloruro di metilene). Recupero da: msdsonline.com
- EPA. (2000). Cloruro di metilene (diclorometano). [PDF]. Estratto da: epa.gov



Nessun utente ha ancora commentato questo articolo.