
Struttura, proprietà e usi dell'eptano (C7H16)
Il eptano è un composto organico la cui formula chimica è C7H16 e comprende nove isomeri strutturali, di cui il più noto è lineare. È un idrocarburo, in particolare un alcano o paraffina, che si trova nella maggior parte dei laboratori di chimica organica, sia didattici che di ricerca..
A differenza di altri solventi paraffinici, l'eptano ha una volatilità inferiore, il che lo rende relativamente più sicuro da usare; a condizione che non vi siano sorgenti di calore intorno ai vapori e si lavori all'interno di una cappa aspirante. Lasciando da parte la sua infiammabilità, è un composto abbastanza inerte da servire come mezzo per le reazioni organiche..
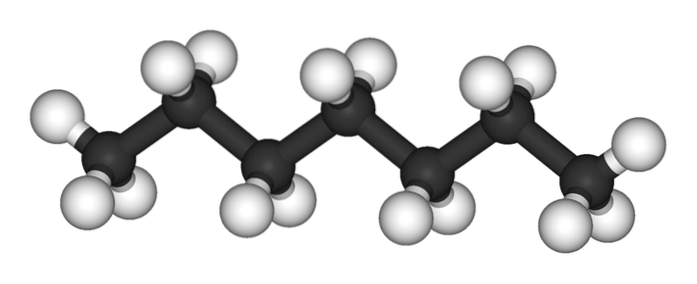
L'immagine in alto mostra la struttura del n-eptano, l'isomero lineare di tutti gli eptani. Poiché è l'isomero più comune e di valore commerciale, nonché il più facile da sintetizzare, si tende a comprendere che il termine 'eptano' si riferisce esclusivamente a n-eptano; salvo diversa indicazione.
Tuttavia, le bottiglie di questo composto liquido specificano che esso contiene n-eptano. Devono essere scoperti all'interno di una cappa aspirante e le misure devono essere prese con cura.
È un ottimo solvente per grassi e oli, motivo per cui viene frequentemente utilizzato durante le estrazioni di essenze vegetali o altri prodotti naturali..
Indice articolo
- 1 Struttura
- 1.1 n-eptano e sue interazioni intermolecolari
- 1.2 Isomeri
- 2 Proprietà dell'eptano
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Punto di fusione
- 2.4 Punto di ebollizione
- 2.5 Pressione di vapore
- 2.6 Densità
- 2.7 Solubilità in acqua
- 2.8 Solubilità in altri solventi
- 2.9 Indice di rifrazione (nD)
- 2.10 Viscosità
- 2.11 Capacità termica
- 2.12 Punto di infiammabilità
- 2.13 Temperatura di autoaccensione
- 2.14 Tensione superficiale
- 2.15 Calore di combustione
- 2.16 Reattività
- 3 usi
- 3.1 Solvente e mezzo di reazione
- 3.2 Agente precipitante
- 3.3 ottano
- 4 Riferimenti
Struttura
n-eptano e sue interazioni intermolecolari
Come si può vedere nella prima immagine, la molecola di n-L'eptano è lineare e, a causa dell'ibridazione chimica dei suoi atomi di carbonio, la catena assume una forma a zigzag. Questa molecola è dinamica, poiché i suoi legami C-C possono ruotare, facendo piegare leggermente la catena ad angoli diversi. Ciò contribuisce alle loro interazioni intermolecolari..
Il n-l'eptano è una molecola apolare e idrofobica, e quindi le sue interazioni sono basate sulle forze dispersive di Londra; Questi sono quelli che dipendono dalla massa molecolare del composto e dalla sua area di contatto. Due molecole di n-eptano si avvicinano l'un l'altro in modo tale da "incuneare" le loro catene una sopra l'altra.
Queste interazioni sono abbastanza efficaci da mantenere le molecole di n-Eptano coesivo in un liquido che bolle a 98 ºC.
Isomeri
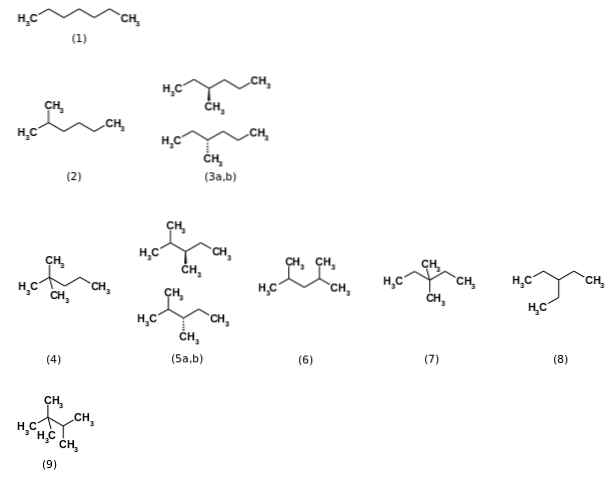
All'inizio si diceva che la formula C7H16 rappresentava un totale di nove isomeri strutturali, essendo il n-eptano il più rilevante (1). Gli altri otto isomeri sono mostrati nell'immagine sopra. Nota a colpo d'occhio che alcuni sono più ramificati di altri. Da sinistra a destra, partendo dall'alto, abbiamo:
(2): 2-metilesano
(3): 3-metilesano, che consiste in una coppia di enantiomeri (aeb)
(4): 2,2-dimetilpentano, noto anche come neoeptano
(5): 2,3-dimetilpentano, sempre con una coppia di enantiomeri
(6): 2,4-dimetilpentano
(7): 3,3-dimetilpentano
(8): 3-etilpentano
(9): 2,2,3-trimetilbutano.
Ciascuno di questi isomeri ha proprietà e applicazioni indipendenti da n-eptano, riservato principalmente alle aree di sintesi organica.
Proprietà eptano
Aspetto fisico
Liquido incolore con un odore simile alla benzina.
Massa molare
100,205 g / mol
Punto di fusione
-90,549 ºC, diventando un cristallo molecolare.
Punto di ebollizione
98,38 ºC.
Pressione del vapore
52,60 atm a 20 ° C. Nota quanto è alta la sua pressione di vapore, nonostante sia meno volatile di altri solventi paraffinici, come esano e pentano..
Densità
0.6795 g / cm3. D'altra parte, i vapori di eptano sono 3,45 volte più densi dell'aria, il che significa che i suoi vapori rimarranno negli spazi in cui un po 'del suo liquido fuoriesce..
Solubilità dell'acqua
L'eptano, essendo un composto idrofobo, può a malapena dissolversi in acqua per produrre una soluzione con una concentrazione dello 0,0003% a una temperatura di 20 ºC..
Solubilità in altri solventi
L'eptano è miscibile con tetracloruro di carbonio, etanolo, acetone, petrolio leggero e cloroformio..
Indice di rifrazione (nD)
1.3855.
Viscosità
0,389 mPa s
Capacità termica
224,64 J / K mol
punto di accensione
-4 ºC
Temperatura di autoaccensione
223 ºC
Tensione superficiale
19,66 mN / ma 25 ºC
Calore di combustione
4817 kJ / mol.
Reattività
I vapori di eptano quando sono vicini a una fonte di calore (una fiamma), reagiscono in modo esotermico e vigoroso con l'ossigeno nell'aria:
C7H16 + 11ODue => 7CODue + 8HDueO
Tuttavia, al di fuori della reazione di combustione, l'eptano è un liquido abbastanza stabile. La sua mancanza di reattività è dovuta al fatto che i suoi legami C-H sono difficili da rompere, quindi non è suscettibile di sostituzioni. Allo stesso modo, non è molto sensibile ai forti agenti ossidanti, purché non ci sia fuoco nelle vicinanze..
Il pericolo maggiore dell'eptano è la sua elevata volatilità e infiammabilità, quindi c'è il rischio di incendio se viene versato in luoghi caldi.
Applicazioni
Solvente e mezzo di reazione

Il carattere idrofobo dell'eptano lo rende un ottimo solvente per sciogliere oli e grassi. In questo aspetto è stato utilizzato come sgrassante. Tuttavia, la sua maggiore applicazione consiste nell'essere utilizzato come solvente estraente, poiché scioglie i componenti lipidici, così come gli altri composti organici di un campione..
Ad esempio, se si volessero estrarre tutti i componenti del caffè macinato, sarebbe macerato in eptano invece che in acqua. Questo metodo e le sue varianti sono state implementate con tutti i tipi di semi, grazie ai quali sono state ottenute essenze vegetali e altri prodotti naturali..
L'eptano, che è naturalmente incolore, si tinge del colore dell'olio estratto. Quindi, viene ruotato per avere finalmente un volume di olio il più puro possibile..
D'altra parte, la bassa reattività dell'eptano consente anche di essere un'opzione quando si considera un mezzo di reazione per effettuare una sintesi. Essendo un buon solvente per composti organici, assicura che i reagenti rimangano in soluzione e interagiscano correttamente tra loro durante la reazione.
Agente precipitante
Nella chimica del petrolio è pratica comune precipitare gli asfalteni da un campione grezzo aggiungendo eptano. Questo metodo consente di studiare la stabilità di diversi oli grezzi e di determinare quanto sia suscettibile il loro contenuto di asfalteni a precipitare e causare tutta una serie di problemi per l'industria petrolifera..
Ottano
L'eptano è stato utilizzato come combustibile a causa della grande quantità di calore che emette quando brucia. Tuttavia, per quanto riguarda i motori delle automobili, sarebbe dannoso per le loro prestazioni se usati in forma pura. Poiché brucia in modo molto esplosivo, serve a definire 0 sulla scala di ottano della benzina..
La benzina contiene un'alta percentuale di eptano e altri idrocarburi per portare il numero di ottano a valori noti (91, 95, 87, 89, ecc.).
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. (10a edizione.). Wiley plus.
- Wikipedia. (2020). Eptano. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Database PubChem eptano. CID = 8900. Estratto da: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Eptani ScienceDirect. Estratto da: sciencedirect.com
- Bell Chem Corp. (7 settembre 2018). Usi industriali dell'eptano. Estratto da: bellchem.com
- Andrea Kropp. (2020). Eptano: struttura, usi e formula. Studia. Estratto da: study.com



Nessun utente ha ancora commentato questo articolo.