
Proprietà del glicole etilenico, struttura chimica, usi
Il glicole etilenico è il composto organico più semplice della famiglia dei glicole. La sua formula chimica è CDueH6ODue, mentre la sua formula strutturale è HOCHDue-CHDueOH. Un glicole è un alcol caratterizzato dall'avere due gruppi idrossilici (OH) attaccati a due atomi di carbonio vicini in una catena alifatica.
Il glicole etilenico è un liquido limpido, incolore e inodore. Nell'immagine sotto ne hai un campione in un barattolo. Inoltre, ha un sapore dolce ed è molto igroscopico. È un liquido leggermente volatile, quindi esercita una pressione di vapore molto piccola, con una densità del vapore maggiore della densità dell'aria..

Il glicole etilenico è un composto dotato di grande solubilità in acqua, oltre ad essere miscibile con molti composti organici; come alcoli alifatici a catena corta, acetone, glicerolo, ecc. Ciò è dovuto alla loro capacità di donare e accettare legami idrogeno da solventi protici (che hanno H).
Il glicole etilenico polimerizza in molti composti, i cui nomi sono spesso abbreviati in PEG e un numero che indica il loro peso molecolare approssimativo. Il PEG 400, ad esempio, è un polimero liquido relativamente piccolo. Mentre i PEG di grandi dimensioni sono solidi bianchi con un aspetto untuoso.
La proprietà del glicole etilenico di abbassare il punto di fusione e aumentare il punto di ebollizione dell'acqua, ne consente l'uso come refrigerante e anticoagulante in veicoli, aeroplani e apparecchiature informatiche.
Indice articolo
- 1 Proprietà
- 1.1 Nomi
- 1.2 Massa molare
- 1.3 Aspetto fisico
- 1.4 Odore
- 1.5 Aroma
- 1.6 Densità
- 1.7 Punto di fusione
- 1.8 Punto di ebollizione
- 1.9 Solubilità in acqua
- 1.10 Solubilità in altri solventi
- 1.11 Punto di infiammabilità
- 1.12 Densità del vapore
- 1.13 Pressione di vapore
- 1.14 Decomposizione
- 1.15 Temperatura di conservazione
- 1.16 Calore di combustione
- 1.17 Calore di vaporizzazione
- 1.18 Tensione superficiale
- 1.19 Indice di rifrazione
- 1.20 Costante di dissociazione
- 1,21 pH
- 1.22 Coefficiente di ripartizione ottanolo / acqua
- 2 Struttura chimica
- 3 Produzione
- 3.1 Ossidazione dell'etilene
- 3.2 Idrolisi dell'ossido di etilene
- 3.3 Processo Omega
- 4 Usi
- 4.1 Liquido refrigerante e antigelo
- 4.2 Disidratazione
- 4.3 Fabbricazione di polimeri
- 4.4 Esplosivi
- 4.5 Protezione del legno
- 4.6 Altre applicazioni
- 5 Avvelenamento e rischi
- 5.1 Sintomi da esposizione
- 5.2 Danni da ingestione
- 5.3 Conseguenze ecologiche del glicole etilenico
- 6 Riferimenti
Proprietà
Nomi
Etano-1,2-diolo (IUPAC), glicole etilenico, glicole monoetilenico (MEG), 1-2-diidrossietano.
Massa molare
62,068 g / mol
Aspetto fisico
Liquido limpido, incolore e viscoso.
Odore
Gabinetto
Gusto
caramella
Densità
1.1132 g / cm3
Punto di fusione
-12,9 ºC
Punto di ebollizione
197,3 ºC
Solubilità dell'acqua
Miscibile con acqua, composto altamente igroscopico.
Solubilità in altri solventi
Miscibile con alcoli alifatici inferiori (metanolo ed etanolo), glicerolo, acido acetico, acetone e chetoni simili, aldeidi, piridina, basi di catrame di carbone e solubile in etere. Praticamente insolubile in benzene e suoi omologhi, idrocarburi clorurati, etere di petrolio e oli.
punto di accensione
111 ºC
Densità del vapore
2.14 in relazione all'aria presa come 1.
Pressione del vapore
0,092 mmHg a 25 ° C (per estrapolazione).
Decomposizione
Quando riscaldato fino alla decomposizione emette fumo acre e irritante.
Temperatura di conservazione
2-8 ºC
Calore di combustione
1.189,2 kJ / mol
Calore di vaporizzazione
50,5 kJ / mol
Tensione superficiale
47,99 mN / ma 25 ºC
Indice di rifrazione
1,4318 a 20 ºC
Costante di dissociazione
pKa = 14,22 a 25 ºC
pH
Da 6 a 7,5 (100 g / L di acqua) a 20 ºC
Coefficiente di ripartizione ottanolo / acqua
Log P = - 1,69
Struttura chimica
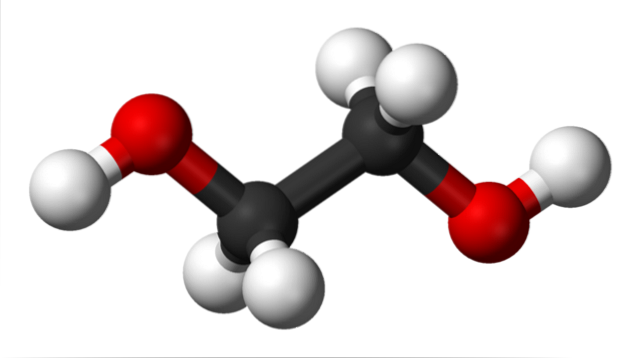
Nell'immagine in alto abbiamo la molecola di glicole etilenico rappresentata da un modello di sfere e barre. Le sfere nere corrispondono agli atomi di carbonio, che compongono il loro scheletro C-C, e alle loro estremità abbiamo rispettivamente le sfere rosse e bianche per gli atomi di ossigeno e idrogeno..
È una molecola simmetrica ea prima vista si può pensare che abbia un momento di dipolo permanente; tuttavia, i loro legami C-OH ruotano, il che favorisce il dipolo. È anche una molecola dinamica, che subisce rotazioni e vibrazioni costanti, ed è in grado di formare o ricevere legami idrogeno grazie ai suoi due gruppi OH..
In effetti, queste interazioni sono responsabili del glicole etilenico con un punto di ebollizione così alto (197 ºC).
Quando la temperatura scende a -13 ºC, le molecole si uniscono in un cristallo ortorombico, dove i rotameri giocano un ruolo importante; cioè, ci sono molecole che hanno i loro gruppi O-H orientati in direzioni diverse.
Produzione
Ossidazione dell'etilene
Il passo iniziale nella sintesi del glicole etilenico è l'ossidazione dell'etilene in ossido di etilene. In passato, l'etilene veniva fatto reagire con acido ipocloroso per produrre cloroidrina. Questo è stato quindi trattato con idrossido di calcio per produrre ossido di etilene..
Il metodo della cloroidrina non è molto redditizio e si è passati a un metodo di ossidazione diretta dell'etilene in presenza di aria o ossigeno, utilizzando l'ossido d'argento come catalizzatore..
Idrolisi dell'ossido di etilene
L'idrolisi dell'ossido di etilene (EO) con acqua sotto pressione produce una miscela grezza. La miscela acqua-glicole viene evaporata e riciclata, separando il glicole monoetilenico dal glicole dietilenico e dal glicole trietilenico mediante distillazione frazionata..
La reazione di idrolisi dell'ossido di etilene può essere delineata come segue:
CDueH4O + HDueO => OH-CHDue-CHDue-OH (glicole etilenico o glicole monoetilenico)
Mitsubishi Chemical ha sviluppato un processo catalitico, attraverso l'uso del fosforo, nella conversione dell'ossido di etilene in glicole monoetilenico.
Processo Omega
Nel processo Omega, l'ossido di etilene viene inizialmente convertito in carbonato di etilene, attraverso la sua reazione con l'anidride carbonica (CODue). Quindi, il carbonato di etilene viene sottoposto ad idrolisi catalitica per ottenere il glicole monoetilenico con selettività del 98%.
Esiste un metodo relativamente nuovo per la sintesi del glicole etilenico. Consiste nella carbonilazione ossidativa del metanolo in dimetil ossalato (DMO) e nella sua successiva idrogenazione in glicole etilenico..
Applicazioni
Liquido di raffreddamento e antigelo
La miscela di glicole etilenico con acqua consente una diminuzione del punto di congelamento e un aumento del punto di ebollizione, consentendo ai motori delle auto di non congelare in inverno, né surriscaldarsi in estate.
Quando la percentuale di glicole etilenico nella miscela con acqua raggiunge il 70%, il punto di congelamento è -55 ºC, quindi la miscela glicole etilenico-acqua può essere utilizzata come liquido di raffreddamento e protezione contro il congelamento nelle condizioni in cui può verificarsi.
Le basse temperature di congelamento delle soluzioni di glicole etilenico ne consentono l'utilizzo come antigelo nei motori delle automobili; sbrinamento delle ali degli aeromobili; e nello sbrinamento dei parabrezza.
Viene inoltre utilizzato per preservare campioni biologici conservati a basse temperature, evitando così la formazione di cristalli che possono danneggiare la struttura dei campioni..
L'alto punto di ebollizione consente di utilizzare soluzioni di glicole etilenico per mantenere basse temperature in dispositivi o apparecchiature che generano calore durante il funzionamento, come: automobili, apparecchiature informatiche, condizionatori d'aria, ecc..
Disidratazione
Il glicole etilenico è un composto molto igroscopico, che ne ha permesso l'utilizzo per trattare i gas estratti dal sottosuolo che hanno un alto contenuto di vapori d'acqua. L'eliminazione dell'acqua dai gas naturali ne favorisce un efficiente utilizzo nei rispettivi processi industriali..
Produzione di polimeri
Il glicole etilenico viene utilizzato per la sintesi di polimeri, come polietilenglicole (PEG), polietilentereftalato (PET) e poliuretano. I PEG sono una famiglia di polimeri utilizzati in applicazioni quali: ispessimento alimentare, trattamento della stitichezza, cosmetici, ecc..
Il PET viene utilizzato nella produzione di tutti i tipi di contenitori usa e getta, che vengono utilizzati in diversi tipi di bevande e alimenti. Il poliuretano è utilizzato come isolante termico nei frigoriferi e come riempitivo in diversi tipi di mobili.
Esplosivi
Viene utilizzato nella produzione di dinamite, consentendo che avendo una diminuzione del punto di congelamento della nitroglicerina, possa essere conservato con meno rischi..
Protezione del legno
Il glicole etilenico viene utilizzato nel trattamento del legno per proteggerlo dal suo marciume, prodotto dall'azione dei funghi. Questo è importante per la conservazione delle opere d'arte del museo.
Altre app
Il glicole etilenico è presente nei mezzi per sospendere i sali conduttivi nei condensatori elettrolitici e negli stabilizzatori della schiuma di soia. Viene anche utilizzato nella produzione di plastificanti, elastomeri e cere sintetiche.
Il glicole etilenico è utilizzato nella separazione di idrocarburi aromatici e paraffinici. Inoltre, viene utilizzato nella produzione di detergenti per attrezzature per la pulizia. Aumenta la viscosità e diminuisce la volatilità dell'inchiostro, rendendolo più facile da usare.
Inoltre, il glicole etilenico può essere utilizzato nella fonderia di sabbia per stampaggio e come lubrificante durante la molatura di vetro e cemento. Viene anche utilizzato come ingrediente nei fluidi per freni idraulici e come intermedio nella sintesi di esteri, eteri, fibre di poliestere e resine..
Tra le resine in cui viene utilizzato il glicole etilenico come materia prima c'è l'alchidica, utilizzata come base di vernici alchidiche, applicata nelle vernici automobilistiche e architettoniche..
Avvelenamento e rischi
Sintomi da esposizione
Il glicole etilenico ha una bassa tossicità acuta quando agisce per contatto con la pelle o se viene inalato. Ma la sua tossicità si manifesta pienamente quando ingerita, essendo indicata come la dose fatale di glicole etilenico di 1,5 g / kg di peso corporeo, o 100 ml per un adulto di 70 kg..
L'esposizione acuta al glicole etilenico produce i seguenti sintomi: l'inalazione provoca tosse, vertigini e mal di testa. Sulla pelle, a contatto con glicole etilenico, si verifica secchezza. Nel frattempo, negli occhi produce rossore e dolore.
Danni da ingestione
L'ingestione di glicole etilenico si manifesta con dolore addominale, nausea, incoscienza e vomito. Un'assunzione eccessiva di glicole etilenico ha un effetto dannoso sul sistema nervoso centrale (SNC), sulla funzione cardiovascolare e sulla morfologia e fisiologia dei reni..
A causa di errori nel funzionamento del sistema nervoso centrale, si verifica paralisi o movimento oculare irregolare (nistagmo). Nel sistema cardiopolmonare sono presenti ipertensione, tachicardia e possibile insufficienza cardiaca. Sono presenti gravi alterazioni nel rene, prodotto dell'avvelenamento con glicole etilenico.
Dilatazione, degenerazione e deposito di ossalato di calcio si verificano nei tubuli renali. Quest'ultimo è spiegato dal seguente meccanismo: il glicole etilenico viene metabolizzato dall'enzima lattico deidrogenasi per produrre glicaldeide.
La glicaldeide dà origine agli acidi glicolico, gliossilico e ossalico. L'acido ossalico precipita rapidamente con il calcio per formare ossalato di calcio, i cui cristalli insolubili si depositano nei tubuli renali, producendo in essi alterazioni morfologiche e disfunzioni che possono portare a insufficienza renale..
A causa della tossicità del glicole etilenico è stato gradualmente sostituito, in alcune sue applicazioni, dal glicole propilenico.
Conseguenze ecologiche del glicole etilenico
Durante lo sbrinamento gli aeroplani rilasciano quantità significative di glicole etilenico, che finisce per accumularsi sulle piste di atterraggio, che una volta lavate fa sì che l'acqua trasferisca il glicole etilenico, attraverso il sistema di drenaggio, ai fiumi dove la sua tossicità influisce sulla vita del l'aereo pesce.
Ma la tossicità del glicole etilenico non è di per sé la causa principale del danno ecologico. Durante la sua biodegradazione aerobica viene consumata una notevole quantità di ossigeno, provocandone la diminuzione nelle acque superficiali.
D'altra parte, la sua biodegradazione anaerobica può rilasciare sostanze tossiche per i pesci, come acetaldeide, etanolo, acetato e metano..
Riferimenti
- Wikipedia. (2019). Glicole etilenico. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. Database PubChem. (2019). 1,2-etandiolo. CID = 174. Estratto da: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Glicole etilenico: struttura, formula e usi. Studia. Estratto da: study.com
- Leroy G. Wade. (27 novembre 2018). Glicole etilenico. Encyclopædia Britannica. Estratto da: britannica.com
- A. Dominic Fortes e Emmanuelle Suard. (2011). Strutture cristalline di glicole etilenico e glicole etilenico monoidrato. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 dicembre 2010). Processo di produzione e produzione di glicole etilenico (EG). Estratto da: icis.com
- Lucy Bell Young. (2019). Quali sono gli utilizzi di Ethylene Glycol? Reagente. Estratto da: chemicals.co.uk
- QuimiNet. (2019). Origine, tipi e applicazioni degli etilenglicoli. Estratto da: quiminet.com
- R. Gomes, R. Liteplo e M.E. Mite. (2002). Glicole etilenico: aspetti della salute umana. Organizzazione mondiale della sanità Ginevra. [PDF]. Estratto da: who.int
Nessun utente ha ancora commentato questo articolo.