
Struttura, tipi ed esempi della struttura cristallina
Il struttura di cristallo È uno degli stati solidi che atomi, ioni o molecole possono adottare in natura, che è caratterizzato da un elevato ordinamento spaziale. In altre parole, questa è la prova dell '"architettura corpuscolare" che definisce molti corpi dalle sembianze vitree e lucenti..
Cosa promuove o quale forza è responsabile di questa simmetria? Le particelle non sono sole, ma interagiscono tra loro. Queste interazioni consumano energia e influenzano la stabilità dei solidi, in modo che le particelle cerchino di adattarsi per ridurre al minimo questa perdita di energia..

Quindi la loro natura intrinseca li porta a collocarsi nella disposizione spaziale più stabile. Ad esempio, questo può essere quello in cui le repulsioni tra ioni con le stesse cariche sono minime, o dove alcuni atomi, come quelli metallici, occupano anche il maggior volume possibile nei loro imballaggi..
La parola "cristallo" ha un significato chimico che può essere travisato per altri corpi. Chimicamente, si riferisce a una struttura ordinata (microscopicamente) che, ad esempio, può essere costituita da molecole di DNA (un cristallo di DNA).
Tuttavia, è comunemente usato impropriamente per riferirsi a qualsiasi oggetto o superficie vetrosa, come specchi o bottiglie. A differenza dei veri cristalli, il vetro è costituito da una struttura amorfa (disordinata) di silicati e molti altri additivi..
Indice articolo
- 1 Struttura
- 1.1 Cella unitaria
- 2 tipi
- 2.1 Secondo il suo sistema cristallino
- 2.2 Secondo la sua natura chimica
- 3 esempi
- 3.1 K2Cr2O7 (sistema triclino)
- 3.2 NaCl (sistema cubico)
- 3.3 ZnS (wurtzite, sistema esagonale)
- 3.4 CuO (sistema monoclino)
- 4 Riferimenti
Struttura
Nell'immagine sopra sono illustrate alcune gemme di smeraldo. Proprio come questi, molti altri minerali, sali, metalli, leghe e diamanti mostrano una struttura cristallina; ma che rapporto ha il suo ordinamento con la simmetria?
Se a un cristallo, le cui particelle potrebbero essere osservate ad occhio nudo, vengono applicate operazioni di simmetria (invertirlo, ruotarlo di diverse angolazioni, rifletterlo su un piano, ecc.), Allora si scoprirà che rimane intatto in tutte le dimensioni di spazio..
L'opposto avviene per un solido amorfo, dal quale si ottengono ordini differenti sottoponendolo ad un'operazione di simmetria. Inoltre, manca di schemi di ripetizione strutturale, il che mostra la casualità nella distribuzione delle sue particelle..
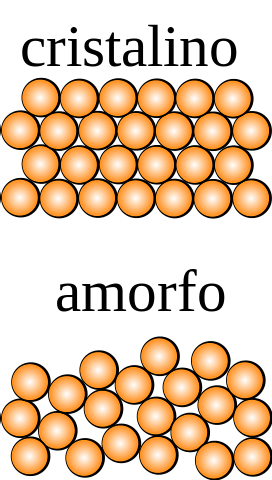
Qual è l'unità più piccola che compone il modello strutturale? Nell'immagine in alto, il solido cristallino è simmetrico nello spazio, mentre quello amorfo non lo è..
Se si disegnassero quadrati che racchiudessero sfere arancioni e si applicassero operazioni di simmetria, si troverebbe che generano altre parti del cristallo.
Quanto sopra si ripete con quadrati sempre più piccoli, fino a trovare quello asimmetrico; quella che la precede per dimensione è, per definizione, la cella unitaria.
Cella unitaria
La cellula unitaria è la minima espressione strutturale che permette la riproduzione completa del solido cristallino. Da questo è possibile assemblare il vetro, spostandolo in tutte le direzioni dello spazio.
Può essere considerato come un piccolo cassetto (baule, secchio, contenitore, ecc.) Dove le particelle, rappresentate da sfere, vengono poste seguendo uno schema di riempimento. Le dimensioni e le geometrie di questa scatola dipendono dalle lunghezze dei suoi assi (a, bec), nonché dagli angoli tra loro (α, β e γ).
La più semplice di tutte le celle unitarie è quella della struttura cubica semplice (immagine in alto (1)). In questo, il centro delle sfere occupa gli angoli del cubo, quattro alla sua base e quattro sul soffitto..
In questa disposizione, le sfere occupano solo il 52% del volume totale del cubo e poiché la natura detesta il vuoto, non molti composti o elementi adottano questa struttura..
Tuttavia, se le sfere sono disposte nello stesso cubo in modo tale da occupare il centro (cubico centrato nel corpo, bcc), allora ci sarà un imballaggio più compatto ed efficiente (2). Ora le sfere occupano il 68% del volume totale.
D'altra parte, in (3) nessuna sfera occupa il centro del cubo, ma il centro delle sue facce, e tutte occupano fino al 74% del volume totale (cubico centrato sulla faccia, cc).
Si può così vedere che per lo stesso cubo si possono ottenere altre disposizioni, variando il modo in cui le sfere sono impacchettate (ioni, molecole, atomi, ecc.).
Tipi
Le strutture cristalline possono essere classificate in base ai loro sistemi cristallini o alla natura chimica delle loro particelle..
Ad esempio, il sistema cubico è il più comune di tutti e molti solidi cristallini sono governati da esso; Tuttavia, questo stesso sistema si applica sia ai cristalli ionici che a quelli metallici..
Secondo il suo sistema cristallino
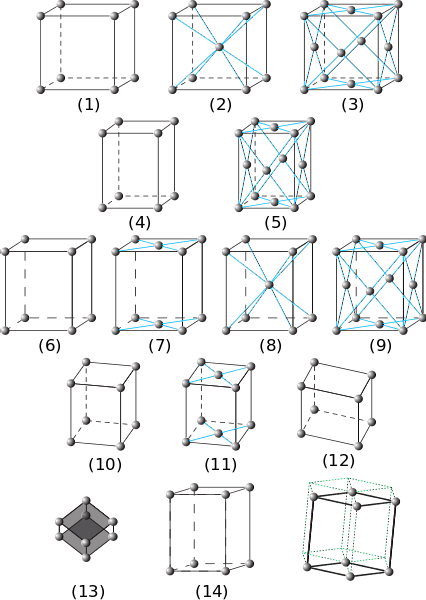
Nell'immagine precedente sono rappresentati i sette sistemi cristallini principali. Si può notare che in realtà sono quattordici di questi, che sono il prodotto di altre forme di imballaggio per gli stessi sistemi e compongono le reti Bravais.
Da (1) a (3) sono cristalli con sistemi cristallini cubici. In (2) si osserva (dalle strisce blu) che la sfera al centro e quella degli angoli interagiscono con otto vicini, quindi le sfere hanno un numero di coordinazione di 8. E in (3) il numero di coordinazione è 12 ( per vederlo è necessario duplicare il cubo in qualsiasi direzione).
Gli elementi (4) e (5) corrispondono a sistemi tetragonali semplici e centrati sulla faccia. A differenza del cubico, il suo asse c è più lungo degli assi aeb.
Da (6) a (9) sono i sistemi ortorombici: da quelli semplici e centrati sulle basi (7), a quelli centrati sul corpo e sulle facce. In questi α, β e γ sono 90º, ma tutti i lati hanno lunghezze diverse.
Le figure (10) e (11) sono i cristalli monoclino e (12) è quello triclino, l'ultimo che presenta disuguaglianze in tutti i suoi angoli e assi..
L'elemento (13) è il sistema romboedrico, analogo a quello cubico ma con angolo γ diverso da 90º. Infine ci sono i cristalli esagonali
Gli spostamenti degli elementi (14) danno origine al prisma esagonale tracciato dalle linee tratteggiate verdi.
Secondo la sua natura chimica
- Se i cristalli sono costituiti da ioni, allora sono cristalli ionici presenti nei sali (NaCl, CaSO4, CuClDue, KBr, ecc.)
- Molecole come il glucosio formano (ogni volta che possono) cristalli molecolari; in questo caso, i famosi cristalli di zucchero.
- Gli atomi i cui legami sono essenzialmente covalenti formano cristalli covalenti. Tali sono i casi del diamante o del carburo di silicio.
- Inoltre, metalli come l'oro formano strutture cubiche compatte, che costituiscono cristalli metallici..
Esempi
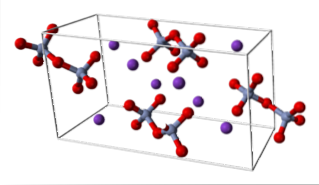
KDueCrDueO7 (sistema triclino)
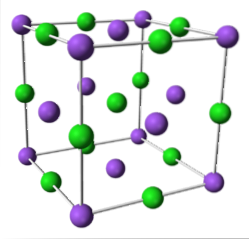
NaCl (sistema cubico)
ZnS (wurtzite, sistema esagonale)
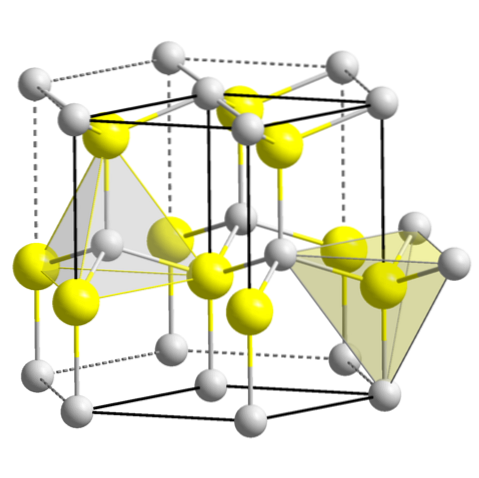
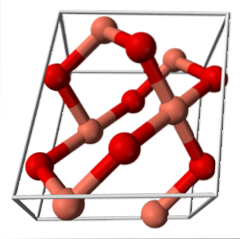
CuO (sistema monoclino)
Riferimenti
- Quimitube. (2015). Perché i "cristalli" non sono cristalli. Estratto il 24 maggio 2018 da: quimitube.com
- Rassegna stampa. 10.6 Strutture reticolari nei solidi cristallini. Estratto il 26 maggio 2018 da: opentextbc.ca
- Centro risorse accademiche Crystal Structures. [PDF]. Estratto il 24 maggio 2018 da: web.iit.edu
- Ming. (30 giugno 2015). Tipi Strutture di cristallo. Estratto il 26 maggio 2018 da: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31 gennaio 2018). Tipi di cristalli. Estratto il 26 maggio 2018 da: thoughtco.com
- KHI. (2007). Strutture cristalline. Estratto il 26 maggio 2018 da: folk.ntnu.no
- Paweł Maliszczak. (25 aprile 2016). Cristalli grezzi di smeraldo provenienti dalla valle del Panjshir in Afghanistan. [Figura]. Estratto il 24 maggio 2018 da: commons.wikimedia.org
- Napy1kenobi. (26 aprile 2008). Bravais reticoli. [Figura]. Estratto il 26 maggio 2018 da: commons.wikimedia.org
- Utente: Sbyrnes321. (21 novembre 2011). Cristallino o amorfo. [Figura]. Estratto il 26 maggio 2018 da: commons.wikimedia.org



Nessun utente ha ancora commentato questo articolo.