
Cambiamenti di tipi di stato e loro caratteristiche (con esempi)

Il cambiamenti di stato o fase sono un fenomeno termodinamico in cui la materia subisce cambiamenti fisici reversibili. Si dice che sia termodinamico perché si verifica un trasferimento di calore tra la materia e l'ambiente circostante; o ciò che è lo stesso, ci sono interazioni tra materia ed energia che inducono un riarrangiamento delle particelle.
Le particelle che subiscono il cambiamento di stato rimangono le stesse prima e dopo il cambiamento. La pressione e la temperatura sono variabili importanti nel modo in cui vengono adattate in una fase o nell'altra. Quando si verifica un cambiamento di stato, si forma un sistema bifasico, costituito dalla stessa materia in due diversi stati fisici.
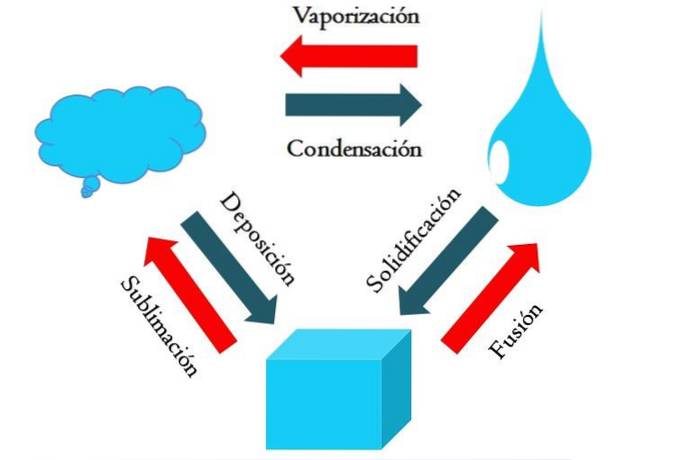
L'immagine sopra mostra i principali cambiamenti di stato che la materia subisce in condizioni normali..
Un cubo solido di una sostanza bluastra può diventare liquido o gassoso a seconda della temperatura e della pressione dell'ambiente circostante. Di per sé rappresenta un'unica fase: il solido. Ma, al momento della fusione, cioè della fusione, viene stabilito un equilibrio solido-liquido chiamato fusione (freccia rossa tra il cubo bluastro e la goccia).
Affinché avvenga la fusione, il cubo deve assorbire calore dall'ambiente circostante per aumentare la sua temperatura; quindi, è un processo endotermico. Una volta che il cubo è completamente sciolto, ritorna ad un'unica fase: quella dello stato liquido.
Questa goccia bluastra può continuare ad assorbire calore, che aumenta la sua temperatura e provoca la formazione di bolle gassose. Anche in questo caso, ci sono due fasi: una liquida e l'altra gassosa. Quando tutto il liquido è evaporato attraverso il suo punto di ebollizione, si dice che sia bollito o vaporizzato..
Ora le gocce bluastre si trasformarono in nuvole. Finora, tutti i processi sono stati endotermici. Il gas blu può continuare ad assorbire calore fino a quando non diventa caldo; Tuttavia, date le condizioni terrestri, tende a raffreddarsi e condensarsi nuovamente nel liquido (condensa)..
D'altra parte, le nuvole possono anche essere depositate direttamente su una fase solida, formando nuovamente il cubo solido (deposizione). Questi ultimi due processi sono esotermici (frecce blu); cioè rilasciano calore nell'ambiente o nell'ambiente circostante.
Oltre alla condensa e alla deposizione, si verifica un cambiamento di stato quando la goccia bluastra si congela a basse temperature (solidificazione).
Indice articolo
- 1 Tipi di cambiamenti di stato e loro caratteristiche
- 1.1 - Fusione
- 1.2 - Vaporizzazione
- 1.3 - Condensa
- 1.4 - Solidificazione
- 1.5 - Sublimazione
- 1.6 - Deposizione
- 2 Altri cambiamenti di stato
- 3 Riferimenti
Tipi di cambiamenti di stato e loro caratteristiche
L'immagine mostra i cambiamenti tipici per i tre stati della materia (più comuni): solido, liquido e gas. I cambiamenti accompagnati dalle frecce rosse sono endotermici, comportando l'assorbimento di calore; mentre quelli accompagnati dalle frecce blu sono esotermici, rilasciano calore.
Di seguito verrà fatta una breve descrizione di ciascuno di questi cambiamenti, evidenziando alcune delle loro caratteristiche dal ragionamento molecolare e termodinamico..
- Fusione
La fusione è il cambiamento di stato di una sostanza da solida a liquida..
Allo stato solido le particelle (ioni, molecole, ammassi, ecc.) Sono "prigionieri", situati in posizioni fisse nello spazio senza potersi muovere liberamente. Tuttavia, sono in grado di vibrare a frequenze diverse e, se sono molto forti, il rigoroso ordine imposto dalle forze intermolecolari inizierà a "sgretolarsi"..
Di conseguenza, si ottengono due fasi: una in cui le particelle rimangono confinate (solide) e un'altra in cui sono più libere (liquide), tanto da aumentare le distanze che le separano. Per ottenere ciò, il solido deve assorbire calore e quindi le sue particelle vibreranno con maggiore forza..
Per questo motivo la fusione è endotermica, e quando inizia si dice che si verifica un equilibrio tra le fasi solido-liquido..
Il calore necessario per dare origine a questo cambiamento è chiamato calore o entalpia molare di fusione (ΔHFus). Esprime la quantità di calore (energia, principalmente in unità di kJ) che una mole di sostanza allo stato solido deve assorbire per fondersi, e non semplicemente aumentare la sua temperatura.
Palla di neve

Con questo in mente, si capisce perché una palla di neve si scioglie nella mano (immagine in alto). La neve assorbe il calore corporeo, il che è sufficiente per aumentare la temperatura della neve oltre 0 ° C.
I cristalli di ghiaccio nella neve assorbono appena il calore necessario per sciogliersi e perché le loro molecole d'acqua assumano una struttura più disordinata. Mentre la neve si sta sciogliendo, l'acqua formata non aumenterà la sua temperatura, poiché tutto il calore della mano viene utilizzato dalla neve per completare il suo scioglimento.
- Vaporizzazione

La vaporizzazione è il cambiamento di stato di una sostanza dallo stato liquido a quello gassoso.
Continuando con l'esempio dell'acqua, ponendo ora una manciata di neve in una pentola e accendendo il fuoco, si osserva che la neve si scioglie velocemente. Man mano che l'acqua si riscalda, al suo interno iniziano a formarsi piccole bolle di anidride carbonica e altre possibili impurità gassose..

Il calore espande molecolarmente le configurazioni disordinate dell'acqua, espandendone il volume e aumentando la sua pressione di vapore; quindi, ci sono diverse molecole che fuoriescono dalla superficie a causa dell'aumento dell'evaporazione.
L'acqua liquida aumenta lentamente la sua temperatura, a causa del suo elevato calore specifico (4.184J / ° C ∙ g). Arriva un punto in cui il calore che assorbe non viene più utilizzato per aumentarne la temperatura, ma per avviare l'equilibrio liquido-vapore; cioè inizia a bollire e tutto il liquido andrà allo stato gassoso assorbendo calore e mantenendo costante la temperatura.
Qui è dove si vedono le intense bolle sulla superficie dell'acqua bollita (immagine in alto). Il calore assorbito dall'acqua liquida in modo che la tensione di vapore delle sue bolle incipienti sia uguale alla pressione esterna è chiamato entalpia di vaporizzazione (ΔHVapore).
Il ruolo della pressione
La pressione è decisiva anche nei cambi di stato. Qual è il suo effetto sulla vaporizzazione? Che maggiore è la pressione, maggiore è il calore che l'acqua deve assorbire per bollire, e quindi, vaporizza sopra i 100 ° C.
Questo perché l'aumento della pressione rende difficile la fuga delle molecole d'acqua dalla fase liquida a quella gassosa..
Le pentole a pressione sfruttano questo fatto a loro vantaggio per riscaldare il cibo in acqua a una temperatura superiore al suo punto di ebollizione..
D'altra parte, poiché c'è un vuoto o una diminuzione della pressione, l'acqua liquida ha bisogno di una temperatura più bassa per bollire ed entrare nella fase gassosa. Con molta o poca pressione, quando l'acqua bolle deve assorbire il suo rispettivo calore di vaporizzazione per completare il suo cambiamento di stato..
- Condensazione
La condensazione è il cambiamento di stato di una sostanza dallo stato gassoso allo stato liquido.

L'acqua è evaporata. Qual è il prossimo? Il vapore acqueo può ancora aumentare la sua temperatura, diventando una corrente pericolosa in grado di provocare gravi ustioni..
Tuttavia, supponiamo che si raffreddi invece. Come? Si dice che il rilascio di calore nell'ambiente e il rilascio di calore sia un processo esotermico che si verifica.
Rilasciando calore, le molecole di acqua gassosa molto energetiche iniziano a rallentare. Inoltre, le loro interazioni diventano più efficaci al diminuire della temperatura del vapore. Le goccioline d'acqua si formeranno per prime, condensate dal vapore, seguite da goccioline più grandi che finiscono per essere attratte dalla gravità.
Per condensare completamente una data quantità di vapore, è necessario rilasciare la stessa energia, ma con segno opposto, a ΔHVapore; cioè la sua entalpia di condensazione ΔHCond. Pertanto, viene stabilito l'equilibrio vapore-liquido inverso.
Finestre umide

La condensa può essere vista sulle finestre delle case stesse. In un clima freddo, il vapore acqueo contenuto all'interno della casa entra in collisione con la finestra, che per il suo materiale ha una temperatura inferiore rispetto ad altre superfici..
Lì, è più facile che le molecole di vapore si aggreghino, creando un sottile strato biancastro facilmente rimovibile a mano. Quando queste molecole rilasciano calore (riscaldando il vetro e l'aria), iniziano a formare ammassi più numerosi fino a quando le prime gocce possono condensare (immagine in alto).
Quando le gocce diventano molto grandi, scivolano giù dalla finestra e lasciano una scia d'acqua.
- Solidificazione
La solidificazione è il cambiamento di stato di una sostanza dallo stato liquido allo stato solido.

La solidificazione avviene a seguito del raffreddamento; in altre parole, l'acqua gela. Per congelare, l'acqua deve rilasciare la stessa quantità di calore che il ghiaccio assorbe per sciogliersi. Di nuovo, questo calore è chiamato entalpia di solidificazione o congelamento, ΔHCong (-ΔHFus).
Quando le molecole d'acqua si raffreddano, perdono energia e le loro interazioni intermolecolari diventano più forti e più direzionali. Di conseguenza, sono disposti grazie ai loro legami idrogeno e formano i cosiddetti cristalli di ghiaccio. Il meccanismo con cui crescono i cristalli di ghiaccio ha un impatto sul loro aspetto: trasparente o bianco.

Se i cristalli di ghiaccio crescono molto lentamente, non occludono le impurità, come i gas che si dissolvono in acqua a basse temperature. Pertanto, le bolle stanno sfuggendo e non possono interagire con la luce; e di conseguenza, hai un ghiaccio trasparente come quello di una straordinaria statua di ghiaccio (immagine in alto).
La stessa cosa che accade con il ghiaccio, può accadere con qualsiasi altra sostanza che si solidifica raffreddandosi. Forse questo è il cambiamento fisico più complesso nelle condizioni terrestri, poiché è possibile ottenere diversi polimorfi.
- Sublimazione
La sublimazione è il cambiamento di stato di una sostanza dallo stato solido allo stato gassoso.
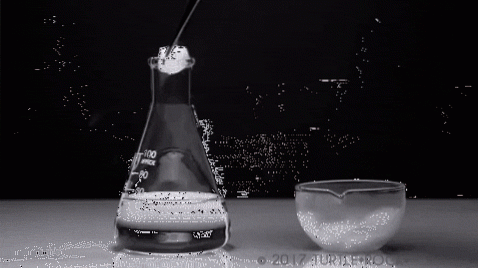
L'acqua può essere sublimata? No, almeno non in condizioni normali (T = 25 ° C, P = 1 atm). Affinché avvenga la sublimazione, cioè il cambiamento di stato da solido a gas, la tensione di vapore del solido deve essere alta.
Allo stesso modo, è essenziale che le loro forze intermolecolari non siano molto forti, preferibilmente se consistono solo di forze di dispersione.
L'esempio più emblematico è lo iodio solido. È un solido cristallino con sfumature grigio-violacee, che presenta un'elevata pressione di vapore. Tant'è che nell'atto di esso si sprigiona un vapore viola, il cui volume ed espansione diventano evidenti se sottoposto a riscaldamento.

Nell'immagine sopra è mostrato un tipico esperimento in cui lo iodio solido viene evaporato in un contenitore di vetro. È interessante e sorprendente osservare come si diffondono i vapori viola e lo studente iniziato può verificare l'assenza di iodio liquido.
Questa è la caratteristica principale della sublimazione: non c'è presenza di una fase liquida. Allo stesso modo, è endotermico, poiché il solido assorbe calore per aumentare la sua pressione di vapore fino a raggiungere la pressione esterna..
- Deposizione

La deposizione è il cambiamento di stato di una sostanza dallo stato gassoso allo stato solido.
Parallelamente all'esperimento della sublimazione dello iodio, c'è quello della sua deposizione. La deposizione è il cambiamento o la transizione opposta: la sostanza passa dallo stato gassoso a quello solido senza la formazione di una fase liquida.
Quando i vapori di iodio viola entrano in contatto con una superficie fredda, rilasciano calore per riscaldarla, perdendo energia e raggruppando le loro molecole nel solido grigio-violaceo (immagine in alto). È quindi un processo esotermico.
La deposizione è ampiamente utilizzata per la sintesi di materiali dove vengono drogati con atomi di metallo mediante tecniche sofisticate. Se la superficie è molto fredda, lo scambio termico tra essa e le particelle di vapore è repentino, omettendo il passaggio attraverso la rispettiva fase liquida..
Il calore o l'entalpia della deposizione (e non depositare) è l'inverso della sublimazione (ΔHSub= - ΔHD.E.P). In teoria molte sostanze possono essere sublimate, ma per ottenere ciò è necessario manipolare le pressioni e le temperature, oltre ad avere a portata di mano il loro diagramma P vs T; in cui possono essere visualizzate le sue possibili fasi lontane.
Altri cambiamenti di stato
Sebbene non se ne faccia menzione, esistono altri stati della materia. A volte sono caratterizzati dall'avere "un po 'di ciascuno", e quindi essere una combinazione di essi. Per generarli, le pressioni e le temperature devono essere manipolate a grandezze molto positive (grandi) o negative (piccole)..
Così, ad esempio, se i gas vengono riscaldati eccessivamente, perderanno i loro elettroni ei loro nuclei caricati positivamente in quella marea negativa costituiranno ciò che è noto come plasma. È sinonimo di "gas elettrico", poiché possiede un'elevata conducibilità elettrica.
D'altra parte, quando le temperature scendono troppo, la materia può comportarsi in modi inaspettati; cioè, mostrano proprietà uniche intorno allo zero assoluto (0 K).
Una di queste proprietà è la superfluidità e la superconduttività; così come la formazione di condensati di Bose-Einstein, dove tutti gli atomi si comportano come uno.
Alcune ricerche puntano addirittura alla materia fotonica. In essi le particelle di radiazione elettromagnetica, i fotoni, si raggruppano per formare molecole fotoniche. Cioè, darebbe massa ai corpi di luce, in teoria.
Riferimenti
- Helmenstine, Anne Marie, Ph.D. (19 novembre 2018). Elenco dei cambiamenti di fase tra gli stati della materia. Estratto da: thoughtco.com
- Wikipedia. (2019). Stato della materia. Estratto da: en.wikipedia.org
- Dorling Kindersley. (2007). Cambiare gli stati. Estratto da: factmonster.com
- Meyers Ami. (2019). Cambio di fase: evaporazione, condensa, congelamento, fusione, sublimazione e deposito. Studia. Estratto da: study.com
- Bagley M. (11 aprile 2016). Materia: definizione e cinque stati della materia. Estratto da: livescience.com
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.


Nessun utente ha ancora commentato questo articolo.