
Proprietà, struttura, usi del cloruro di piombo
Il cloruro di piombo è un sale inorganico la cui formula chimica è PbCln, dove n è il numero di ossidazione del piombo. Quindi, quando il piombo è +2 o +4, il sale è PbClDue o PbCl4, rispettivamente. Pertanto, ci sono due tipi di cloruri per questo metallo.
Dei due, il PbClDue è il più importante e stabile; mentre PbCl4 è instabile e meno utile. Il primo è di natura ionica, dove il catione PbDue+ genera interazioni elettrostatiche con l'anione Cl- costruire un reticolo cristallino; e il secondo è covalente, con legami Pb-Cl che originano un tetraedro di piombo e cloro.

Un'altra differenza tra i due cloruri di piombo è quella PbClDue È un solido di cristalli bianchi a forma di aghi (immagine in alto); mentre PbCl4 È un olio giallastro che può cristallizzare a -15ºC. Ingresso PbClDue è più estetico di PbCl4.
Oltre a quanto già accennato, il PbClDue si trova in natura come minerale cotunite; mentre il PbCl4 no, poiché è suscettibile di decadimento. Sebbene da PbCl4 puoi ottenere il PbODue, di PbClDue derivano una varietà infinita di composti organometallici.
Indice articolo
- 1 Proprietà
- 1.1 -Piombo (II) cloruro
- 1.2 Cloruro di piombo (IV)
- 2 Struttura
- 2.1 -Piombo (II) cloruro
- 2.2 Molecola in fase gassosa
- 3 Nomenclatura
- 4 Usi
- 5 Riferimenti
Proprietà
Le proprietà del cloruro di piombo dipendono essenzialmente dal numero di ossidazione del piombo; poiché il cloro non cambia, ma cambia il modo in cui interagisce con il piombo. Pertanto, entrambi i composti devono essere affrontati separatamente; cloruro di piombo (II) da un lato e cloruro di piombo (IV) dall'altro.
-Cloruro di piombo (II)
Massa molare
278,10 g / mol.
Aspetto fisico
Cristalli di colore bianco con forme ad ago.
Densità
5,85 g / mL.
Punto di fusione
501ºC.
Punto di ebollizione
950ºC.
Solubilità dell'acqua
10,8 g / L a 20 ° C. È scarsamente solubile e l'acqua deve essere riscaldata in modo che una notevole quantità possa dissolversi.
Indice di rifrazione
2.199.
Cloruro di piombo (IV)
Massa molare
349,012 g / mol.
Aspetto fisico
Liquido oleoso giallastro.
Densità
3,2 g / mL.
Punto di fusione
-15ºC.
Punto di ebollizione
50 ° C. A temperature più elevate si decompone rilasciando cloro gassoso:
PbCl4(s) => PbClDue(s) + ClDue(g)
In effetti, questa reazione può diventare molto esplosiva, quindi il PbCl viene immagazzinato.4 in acido solforico a -80ºC.
Struttura
-Cloruro di piombo (II)
In un primo momento è stato detto che PbClDue è un composto ionico, quindi è costituito da ioni PbDue+ e Cl- che costruiscono un cristallo in cui si stabilisce un rapporto Pb: Cl pari a 1: 2; cioè, ci sono il doppio degli anioni Cl- quali cationi PbDue+.
Il risultato è che si formano cristalli ortorombici i cui ioni possono essere rappresentati con un modello di sfere e barre come nell'immagine sottostante..

Questa struttura corrisponde anche a quella del minerale cotunite. Sebbene le barre siano usate per indicare una direzionalità del legame ionico, non deve essere confusa con un legame covalente (o almeno, puramente covalente).
In questi cristalli ortorombici il PbDue+ (sfere grigiastre) ha nove Cl- (sfere verdi) che lo circondano, come se fosse racchiuso in un prisma triangolare. A causa della complessità della struttura e della bassa densità ionica di PbDue+, è difficile per le molecole solvatare il cristallo; motivo per cui è scarsamente solubile in acqua fredda.
Molecola di fase gassosa
Quando né il cristallo né il liquido possono resistere alle alte temperature, gli ioni iniziano a vaporizzare come molecole di PbCl.Due discreto; cioè con legami covalenti Cl-Pb-Cl e un angolo di 98º, come se fosse un boomerang. Si dice quindi che la fase gassosa sia costituita da queste molecole di PbClDue e nessun ioni trasportati dalle correnti d'aria.
Cloruro di piombo (IV)
Nel frattempo, il PbCl4 è un composto covalente. Perché? Perché il catione Pb4+ è più piccolo e ha anche una densità di carica ionica maggiore del PbDue+, che provoca una maggiore polarizzazione della nuvola di elettroni Cl-. Il risultato è che invece di un'interazione di tipo ionico Pb4+Cl-, si forma il legame covalente Pb-Cl.
Considerando questo, la somiglianza tra PbCl4 e, ad esempio, il CCl4; entrambi si presentano come singole molecole tetraedriche. Quindi, è spiegato perché questo cloruro di piombo è un olio giallastro in condizioni normali; Gli atomi di Cl sono scarsamente correlati tra loro e "scivolano" quando due molecole di PbCl4 stanno arrivando.
Tuttavia, quando la temperatura scende e le molecole rallentano, la probabilità e gli effetti dei dipoli istantanei (PbCl4 è apolare data la sua simmetria); e poi l'olio si congela come cristalli esagonali gialli:
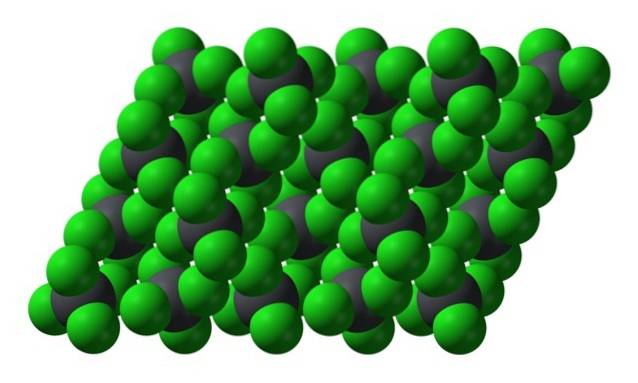
Nota che ogni sfera grigiastra è circondata da quattro sfere verdi. Queste molecole di PbCl4 "Squeezed together" costituiscono un cristallo instabile che è suscettibile di una forte decomposizione.
Nomenclatura
I nomi: piombo (II) cloruro e piombo (IV) cloruro corrispondono a quelli assegnati secondo la nomenclatura Stock. Poiché il numero di ossidazione +2 è il più basso per il piombo e +4 il più alto, entrambi i cloruri possono essere denominati secondo la nomenclatura tradizionale come cloruro di plumbose (PbClDue) e cloruro di piombo (PbCl4), rispettivamente.
E infine, c'è la nomenclatura sistematica, che evidenzia il numero di ogni atomo nel composto. Pertanto, il PbClDue è piombo dicloruro e PbCl4 piombo tetracloruro.
Applicazioni
Non è noto un uso pratico per PbCl4 oltre a servire per la sintesi di PbODue. Tuttavia, il PbClDue È più utile ed è per questo che di seguito verranno elencati solo alcuni usi per questo specifico cloruro di piombo:
- A causa della sua natura altamente luminescente, è destinato a dispositivi fotografici, acustici, ottici e rilevatori di radiazioni.
- Poiché non assorbe nella regione dello spettro infrarosso, viene utilizzato per la fabbricazione di occhiali che trasmettono questo tipo di radiazione.
- Ha fatto parte di quello che viene chiamato vetro dorato, un materiale attraente con colorazioni bluastre iridescenti utilizzato per scopi ornamentali..
- Inoltre, proseguendo in tema di arte, quando alcalinizzato, PbClDuePb (OH)Due Acquisisce intensi toni biancastri, essendo utilizzato come pigmento bianco piombo. Tuttavia, il suo utilizzo è stato sconsigliato a causa della sua elevata tossicità..
- Fuso e mescolato con titanato di bario, BaTiO3, dà origine al titanato di bario piombo ceramico Ba1 - xPbXZio3. Se un PbDue+ entrare nel BaTiO3, a BaDue+ deve lasciare il cristallo per consentire la sua incorporazione e si dice che avvenga uno scambio cationico; da qui la composizione del BaDue+ è espresso come 1-x.
- E infine, dal PbClDue vengono sintetizzati diversi composti di piombo organometallici di formula generale R.4Pb o R3Pb-PbR3.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Cloruro di piombo (II). Estratto da: en.wikipedia.org
- Formulazione chimica. (2019). Cloruro di piombo (IV). Estratto da: formulacionquimica.com
- Clark Jim. (2015). I cloruri di carbonio, silicio e piombo. Estratto da: chemguide.co.uk
- Studi spettrali e ottici non lineari sul cloruro di piombo (PbClDue) cristalli. [PDF]. Estratto da: shodhganga.inflibnet.ac.in
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Cloruro di piombo. Database PubChem; CID = 24459. Estratto da: pubchem.ncbi.nlm.nih.gov


Nessun utente ha ancora commentato questo articolo.