
Proprietà, reazioni e usi dell'acido silicico

Il acido silicico è una forma idrata di ossido di silicio. È il nome generico per la famiglia di composti chimici formati da un silicio e una certa quantità di molecole di idrogeno e ossigeno..
La formula generale di questi acidi è [SiOX(OH)4-2x]n, e la forma più comune in cui si trova di solito è in quella dell'acido ortosilicico H4sì4.
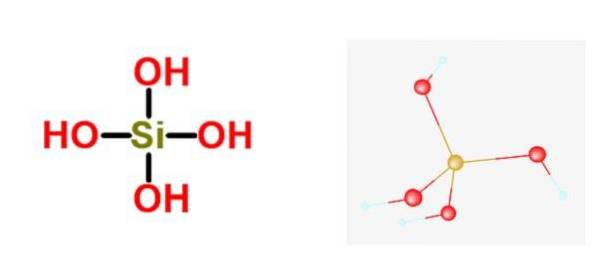
L'acido silicico fa parte della famiglia Miscellaneous Silicates. Ciò significa che il più grande oxoanion metallico è il silicato e che nessun atomo non metallico è attaccato ad esso. Ci sono alcuni casi isolati in cui hanno un atomo non metallico, ma mai più di uno.
Proprietà fisiche dell'acido silicico
L'acido silicico esiste solo in due stati, amorfo e cristallino. Il primo è ottenuto da un processo di precipitazione e il secondo si presenta come cristallo di rocca.
Acido silicico nella sua forma amorfa (SiO3) è bianco, insapore, insolubile in acqua e non forma con le molecole di sé una massa plastica coesiva come avviene con l'alluminio.
Allo stato cristallino non viene sciolto da alcun ossacido. Quando una soluzione molto diluita di soluzione di silice viene trattata con acido solforico, nitrico o cloridrico, l'acido silicico non viene precipitato. Invece, sembra essere sciolto in acqua come idrato.
Quando una soluzione dell'acido o dell'acido viene aggiunta ad una soluzione di silicato, l'idrato viene precipitato in una forma gelatinosa che quando viene essiccata e successivamente riscaldata con grande energia diventa una sostanza insolubile.
Reazioni chimiche
L'acido silicico è estremamente debole e perde il suo primo protone solo quando si avvicina a pH 10. Solo 3 reazioni note con questo acido si verificano in normali condizioni fisiologiche di vita..
- Reazione con se stesso quando la solubilità viene superata per formare idrato di silice amorfa.
- La sua reazione con idrossido di alluminio per formare idrossido di silicato di alluminio.
- Reazione con molibdato in eccesso per formare eteropoliacidi come il silicomolibdato.
Dove si trova l'acido silicico?
Dopo l'ossigeno, il silicio è l'elemento più comune in natura, è sotto forma di cristalli. Quando è in mezzo acquoso diventa non ionizzante, quindi i sali di silicio nell'oceano possono acidificare il silicio e creare acido silicico..
Gli input netti di acido silicico nell'oceano mondiale sono stati trovati a 6,1 ± 2,0 teramoli di silicio all'anno (1 teramolo = 1012 moli). Quasi l'80% di questo contributo proviene da fiumi la cui concentrazione media globale è di 150 micromolare (concentrazione in acqua).
Nei moderni sedimenti marini, le rese nette di silicio biogenico (trasformazione del silicato disciolto in materiale scheletrico particolato) sono 7,1 ± 1,8 teramoli all'anno.
La produzione lorda di silice biogenica nelle acque superficiali è di 240 ± 40 teramoli di silicio all'anno e il rapporto di conservazione (accumulo di opale nei sedimenti / produzione lorda nelle acque superficiali) è del 3%..
Nella flora si può trovare nella pianta Borago officinalis (Borraje), che nella sua composizione contiene fino al 2,2% di acido silicico.
L'acido ortosilicico è la forma più comune di acido silicico, che può essere trovato in molti luoghi diversi. Le maggiori fonti biodisponibili di questo acido si trovano nell'acqua, nell'acqua di mare o in altre bevande come la birra..
Per ottenerlo in laboratorio segue lo stesso principio dell'oceano, può essere ottenuto acidificando il silicato di sodio in una soluzione acquosa..
Utilizza nella vita di tutti i giorni
Dentifricio
È il gel abrasivo utilizzato nel dentifricio, o nella parte trasparente del dentifricio graffiato, poiché in combinazione con il carbonato di calcio, aiuta a rimuovere in sicurezza la placca con lo spazzolamento.
È registrato come composto sicuro presso la Food & Drug Administration degli Stati Uniti e non ha tossicità o cancerogenicità nota.
Essiccante
Quando viene essiccato in un forno, perde acqua e diventa un essiccante (una sostanza che attira l'acqua dall'aria). Pertanto, piccoli pacchetti di cristalli di gel di silice possono essere trovati in contenitori il cui contenuto può essere danneggiato dall'umidità come bottiglie di vitamine, dispositivi elettronici, scarpe o prodotti in pelle..
Altri usi
Può essere trovato nei negozi di articoli da regalo come pietre magiche, giardino chimico o giardino di cristallo. La sua forma secca è mescolata con sali di metalli diversi.
Quando il sodio viene gettato nell'acqua viene sostituito dal metallo e poiché il silicato metallico non è solubile in acqua, si forma un precipitato del colore caratteristico del metallo. Il silicato metallico si espande anche come gel e cresce come stalagmiti colorate nell'acqua..
Benefici medici dell'acido ortosilicico (OSA)
L'acido ortosilicico è il miglior mezzo siliconico biodisponibile per l'uomo. Può essere usato per trattare varie condizioni di salute come il morbo di Alzheimer, l'artrite, l'aterosclerosi, l'ipertensione, le malattie cardiache, l'osteoporosi, l'ictus e i capelli.
Salute delle ossa
In uno studio del 2008 su 136 donne con osteopenia, è stato somministrato loro acido ortosilicico insieme a calcio e vitamina D o un placebo ogni giorno per un anno. Dopo un anno, i partecipanti che hanno ricevuto l'acido hanno migliorato la formazione ossea.
Gli scienziati dicono che ciò è dovuto alla capacità dell'acido ortosilicico di stimolare la produzione di collagene (una proteina presente nel tessuto connettivo) e di promuovere lo sviluppo di cellule che formano l'osso..
Salute dei capelli
Un piccolo studio pubblicato nel 2007 suggerisce che questo acido può aiutare a migliorare la qualità e la salute dei capelli. Nello studio, 48 donne con "capelli fini" sono state divise in due gruppi e hanno ricevuto un placebo o un integratore di orthosilicon per nove mesi..
I ricercatori hanno scoperto che l'acido ortosalicilico sembrava aumentare la forza e lo spessore dei capelli. In generale, la qualità dei capelli è stata migliorata anche con l'integrazione di acido ortosalicilico.
Riferimenti
- Centro nazionale per le informazioni sulla biotecnologia. Database composto di PubChem; CID = 14942. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Graham, T. (1863). Sulle proprietà dell'acido silicico e di altre sostanze colloidali analoghe. Atti della Royal Society of London, 13, 335-341. Estratto da: jstor.org.
- The Editors of Encyclopedia Britannica (1998) Silicic Acid Chemical Compound. Encyclopedia Britannica. Estratto da: britannica.com.
- Tomsofmaine.com. (2017). Silice idrata | Tom's of Maine. [in linea] Estratto da: tomsofmaine.com.
- William Thomas Brande, Alfred Swaine Taylor. Chimica. Blanchard e Lea. [online] Estratto il 21 marzo 2017 da books.google.co.ve.id.
- Field, S. (2017). Silice idrata. [online] Estratto il 22 marzo 2017 da: sci-toys.com.


Nessun utente ha ancora commentato questo articolo.