
Proprietà, rischi e usi dell'acido perbromico (HBrO4)

Il acido perbromico oppure l'acido tetraosso bromico è un composto inorganico di formula HBrO4. La sua struttura è presentata nella figura 1 (EMBL-EBI, 2007). È un acido bromo ossiacido, dove ha uno stato di ossidazione 7+.
È instabile e non si forma per spostamento del cloro dall'acido perclorico poiché si prepara l'acido perbromico; può essere fatto solo mediante protonazione dello ione perbromato.
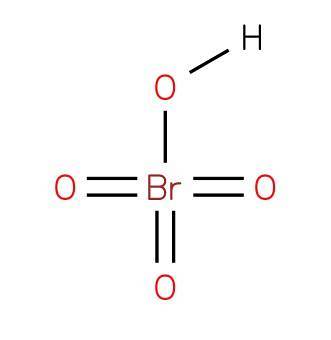
L'acido perbromico è un acido forte e un potente agente ossidante. È il meno stabile degli ossacidi alogeni (VII). Si decompone rapidamente in acido bromico e ossigeno rilasciando fumi tossici di bromo bruno.
La sua base coniugata è lo ione perbromato che, a differenza dei perclorati, non è accessibile per elettrolisi. Si forma facendo reagire i bromati con l'ozono o quando l'acido perbromico reagisce con le basi (Ropp, 2013). È stata sviluppata una nuova sintesi di perbromati, che consiste nell'ossidazione del bromato con fluoro in soluzione alcalina.
Fra3- + FDue + HDueO → BrO4- + HF
È stato scoperto dal decadimento di un campione di selenato radioattivo (SeO4-). Il composto viene anche prodotto esponendo cristalli di bromato a radiazioni γ (A. J. Downs, 1973)
L'acido perbromico è un acido monobasico forte. Le sue soluzioni acquose sono stabili fino a circa 6 M (55% HBrO4) ma si decompongono a concentrazioni più elevate (Appelman, 1969).
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche
L'acido perbromico esiste solo in soluzione. È un liquido incolore senza un aroma caratteristico (National Center for Biotechnology Information, 2017).
Il composto ha un peso molecolare di 144,908 g / mol. Data la sua instabilità, le sue proprietà sono state calcolate con metodi computazionali, ottenendo che ha un punto di fusione e di ebollizione rispettivamente di 204,77 ° C e 512,23 ° C..
La sua solubilità in acqua, ottenuta anche tramite calcoli computazionali, è dell'ordine di 1 x 106 mg per litro a 25 ° C (Royal Society of Chemistry, 2015). L'acido perbromico è un acido forte, con un solo protone per ogni atomo di bromo eptavalente. In soluzione acquosa, lo ione idronio e BrO sono completamente dissociati4-.
Le soluzioni con concentrazioni maggiori di 6 M (55% p / v) sono instabili in aria, si verifica una decomposizione autocatalitica del composto, che è completa a concentrazioni dell'80%. Questa reazione di decomposizione è anche catalizzata da metalli come il Ce4+ e Ag+ (Egon Wiberg, 2001).
Reattività e rischi
L'acido perbromico è un composto instabile, tuttavia ha forti proprietà acide quando isolato. È estremamente pericoloso in caso di contatto con la pelle (è corrosivo e irritante), a contatto con gli occhi (irritante) e in caso di ingestione. Molto pericoloso anche in caso di inalazione.
Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte. L'esposizione prolungata può provocare ustioni e ulcerazioni della pelle. La sovraesposizione inalatoria può causare irritazione respiratoria..
L'infiammazione degli occhi è caratterizzata da arrossamento, lacrimazione e prurito. L'infiammazione della pelle è caratterizzata da prurito, desquamazione, arrossamento e occasionalmente vesciche.
La sostanza è tossica per i reni, i polmoni e le mucose. L'esposizione ripetuta o prolungata alla sostanza può causare danni a questi organi..
In caso di contatto con gli occhi, controllare se si indossano lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, tenendo le palpebre aperte. È possibile utilizzare acqua fredda. Unguento per gli occhi non deve essere utilizzato.
Se la sostanza chimica viene a contatto con gli indumenti, rimuoverla il più rapidamente possibile, proteggendo le mani e il corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula sulla pelle esposta della vittima, come le mani, la pelle contaminata viene lavata delicatamente e accuratamente con acqua corrente e sapone non abrasivo..
L'acido può anche essere neutralizzato con idrossido di sodio diluito o una base debole come il bicarbonato di sodio. Se l'irritazione persiste, consultare il medico. Lavare gli indumenti contaminati prima di riutilizzarli.
Se il contatto con la pelle è grave, deve essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
In caso di inalazione, consentire alla vittima di riposare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il prima possibile..
Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta. Se la vittima ha difficoltà a respirare, deve essere somministrato ossigeno. Se la vittima non respira, viene eseguita la rianimazione bocca a bocca.
Sempre tenendo conto che può essere pericoloso per la persona che fornisce aiuto eseguire la rianimazione bocca a bocca, quando il materiale inalato è tossico, infettivo o corrosivo.
In caso di ingestione, non provocare il vomito. Allenta indumenti stretti come colletti di camicie, cinture o cravatte. Se la vittima non respira, eseguire la rianimazione bocca a bocca. In tutti i casi, consultare immediatamente un medico..
Applicazioni
L'uso principale dell'acido perbromico è come agente riducente in laboratorio. Le soluzioni diluite di acido perbromico sono agenti ossidanti lenti nonostante il loro grande potenziale REDOX (+1,76 volt), tuttavia è un ossidante migliore dell'acido perclorico.
L'acido perbromico può ossidare lentamente gli ioni bromuro e ioduro. In soluzioni di concentrazione molare 12 può ossidare rapidamente lo ione cloruro ed esplodere in presenza di acido nitrico. Soluzioni di 3 concentrazioni molari di acido perbromico possono facilmente ossidare l'acciaio inossidabile.
Ad una temperatura di 100 ° C, 6 soluzioni molari di acido perbromico possono ossidare lo ione manganese (MnDue+) per permanganato (MnO4-). La riduzione del composto a bromo può essere ottenuta con cloruro di stagno (SnODue).
L'altro uso dell'acido perbromico è la sintesi di sali di perbromato come il perbromato di sodio o il perbromato di potassio..
Quest'ultimo è un composto abbastanza stabile che resiste a temperature di 274 ° C. A temperature più elevate si riduce a bromato di potassio, a differenza del perclorato che ad alte temperature produce ossigeno e cloruro di potassio.
Riferimenti
- J. Downs, C. J. (1973). La chimica del cloro, del bromo, dello iodio e dell'astato. Oxford: Pergamon press LTD.
- Appelman, E. H. (1969). Acido perbromico e perbromati: sintesi e alcune proprietà. Chimica Inorganica 8 (2) , 223-227. Recuperato da researchgate.net.
- Egon Wiberg, N. W. (2001). Chimica inorganica. New York: Academic Press.
- EMBL-EBI. (2007, 28 ottobre). acido perbromico. Recupero da ebi.ac.uk.
- Centro nazionale per le informazioni sulla biotecnologia. (30 aprile 2017). Database composto di PubChem; CID = 192513. Recupero da pubchem.ncbi.nlm.nih.gov.
- Ropp, R. C. (2013). Enciclopedia dei composti alcalini terrosi. Oxford: Elsevier.
- Royal Society of Chemistry. (2015). Acido perbromico. Recupero da chemspider.com.


Nessun utente ha ancora commentato questo articolo.