
Processo di solvatazione, differenze con l'idratazione ed esempi

Il solvatazione è il legame fisico e chimico tra le particelle di soluto e solvente in una soluzione. Si differenzia dal concetto di solubilità per il fatto che non esiste un equilibrio termodinamico tra un solido e le sue particelle disciolte..
Questa unione è responsabile della "scomparsa" dei solidi disciolti alla vista degli spettatori; quando in realtà le particelle diventano molto piccole e finiscono per essere "ricoperte" da fogli di molecole di solvente, il che le rende impossibili da osservare.
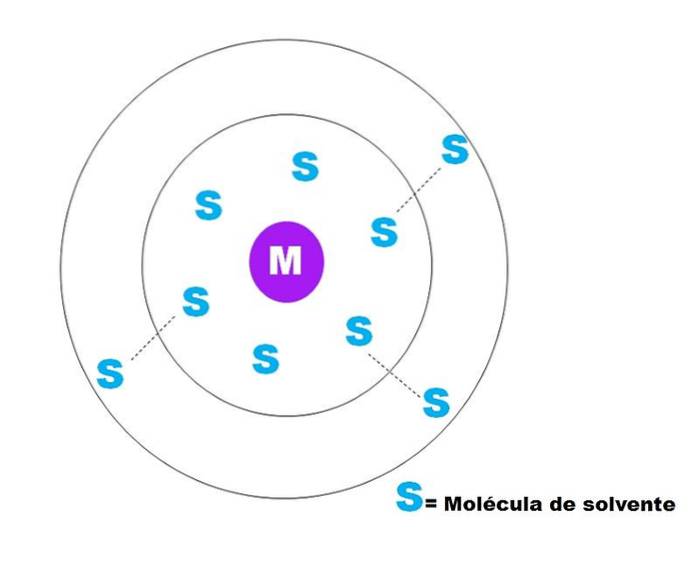
Nell'immagine sopra è rappresentato uno schizzo molto generale della solvatazione di una particella M. M potrebbe essere uno ione (M+) o una molecola; e S è la molecola del solvente, che può essere qualsiasi composto allo stato liquido (sebbene possa anche essere gassoso).
Nota che M è circondato da sei molecole di S, che compongono ciò che è noto come sfera di solvatazione primaria. Altre molecole di S a maggiore distanza interagiscono dalle forze di Van der Waals con le prime, formando una sfera di solvatazione secondaria, e così via fino a quando un certo smistamento non è evidente..
Indice articolo
- 1 Processo di risoluzione
- 2 Aspetti energetici
- 3 Interazioni intermolecolari
- 4 Differenze con l'idratazione
- 5 esempi
- 5.1 Cloruro di calcio
- 5.2 Urea
- 5.3 nitrato di ammonio
- 6 Riferimenti
Processo di risoluzione
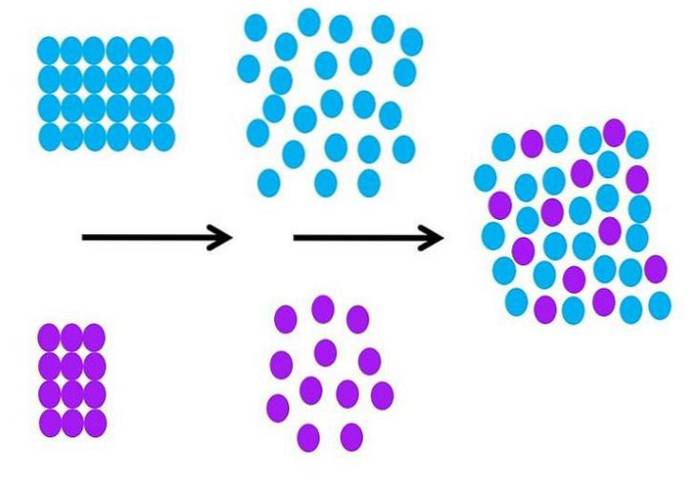
A livello molecolare, com'è il processo di solvatazione? L'immagine sopra riassume i passaggi necessari.
Le molecole di solvente, di colore blu, sono inizialmente ordinate, tutte interagendo tra loro (S-S); e le particelle di soluto viola (ioni o molecole) fanno lo stesso con interazioni M-M forti o deboli.
Affinché avvenga la solvatazione, sia il solvente che il soluto devono espandersi (seconda freccia nera) per consentire le interazioni soluto-solvente (M-S)..
Ciò implica necessariamente una diminuzione delle interazioni soluto-soluto e solvente-solvente; diminuzione che richiede energia, e quindi questo primo passaggio è endotermico.
Una volta che il soluto e il solvente si sono espansi molecolarmente, i due si mescolano e si scambiano di posto nello spazio. Ogni cerchio viola nella seconda immagine può essere paragonato a quello nella prima immagine.
Un cambiamento nel grado di ordinamento delle particelle può essere dettagliato nell'immagine; ordinato all'inizio e disordinato alla fine. Di conseguenza, l'ultimo passaggio è esotermico, poiché la formazione delle nuove interazioni M-S stabilizza tutte le particelle nella soluzione..
Aspetti energetici
Dietro il processo di solvatazione, ci sono molti aspetti energetici che devono essere presi in considerazione. Primo: interazioni S-S, M-M e M-S.
Quando le interazioni M-S, cioè tra il soluto e il solvente, sono molto più elevate (forti e stabili) rispetto a quelle dei singoli componenti, si parla di un processo di solvatazione esotermico; e quindi, l'energia viene rilasciata al mezzo, che può essere verificata misurando l'aumento di temperatura con un termometro.
Se, al contrario, le interazioni M-M e S-S sono più forti delle interazioni M-S, allora per “espandersi” avranno bisogno di più energia di quanta ne guadagnano una volta completata la solvatazione..
Si parla quindi di un processo di solvatazione endotermico. Stando così le cose, viene registrato un calo di temperatura o, al contrario, l'ambiente circostante viene raffreddato.
Ci sono due fattori fondamentali che determinano se un soluto si dissolve o meno in un solvente. Il primo è il cambiamento di entalpia della soluzione (ΔHdis), come appena spiegato, e la seconda è la variazione di entropia (ΔS) tra il soluto e il soluto disciolto. Generalmente, ΔS è associato all'aumento del disturbo anche menzionato sopra.
Interazioni intermolecolari
È stato detto che la solvatazione è il risultato del legame fisico e chimico tra il soluto e il solvente; Tuttavia, come sono esattamente queste interazioni o unioni?
Se il soluto è uno ione, M+, si verificano le cosiddette interazioni ione-dipolo (M+-S); e se è una molecola, ci saranno interazioni dipolo-dipolo o forze di diffusione di Londra.
Quando si parla di interazioni dipolo-dipolo, si dice che esiste un momento di dipolo permanente in M e S. Pertanto, la regione δ- ricca di elettroni di M interagisce con la regione δ + povera di elettroni di S. Il risultato di tutte queste interazioni è la formazione di diverse sfere di solvatazione attorno a M.
Inoltre, c'è un altro tipo di interazione: il coordinativo. Qui, le molecole S formano legami di coordinazione (o dativi) con M, formando varie geometrie.
Una regola fondamentale per memorizzare e prevedere l'affinità tra il soluto e il solvente è: uguale dissolve uguale. Pertanto, le sostanze polari si dissolvono molto facilmente in solventi ugualmente polari; e sostanze non polari, si dissolvono in solventi non polari.
Differenze con l'idratazione
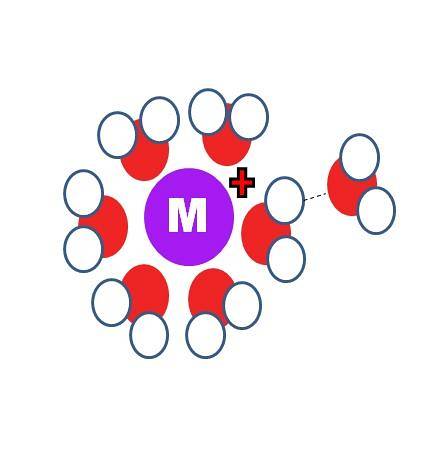
In che modo la solvatazione è diversa dall'idratazione? I due processi identici, tranne che le molecole S, nella prima immagine, vengono sostituite da quelle dell'acqua, H-O-H.
Nell'immagine in alto puoi vedere un catione M+ circondato da sei molecole H.DueO. Nota che gli atomi di ossigeno (di colore rosso) sono diretti verso la carica positiva, perché è la più elettronegativa e quindi ha la più alta densità negativa δ-.
Dietro la prima sfera di idratazione, altre molecole d'acqua sono raggruppate attorno a legami idrogeno (OHDue-OhDue). Queste sono interazioni ione-dipolo. Tuttavia, le molecole d'acqua possono anche formare legami di coordinazione con il centro positivo, specialmente se è metallico..
Così, i famosi acquacomplessi, M (OHDue)n. Poiché n = 6 nell'immagine, le sei molecole sono orientate attorno a M in un ottaedro di coordinazione (la sfera interna di idratazione). A seconda della taglia di M+, l'entità della sua carica e la sua disponibilità elettronica, questa sfera può essere più piccola o più grande.
L'acqua è forse il solvente più sorprendente di tutti: dissolve una quantità incommensurabile di soluti, è un solvente troppo polare e ha una costante dielettrica anormalmente alta (78,5 K).
Esempi
Di seguito vengono menzionati tre esempi di solvatazione in acqua.
Cloruro di calcio
La dissoluzione del cloruro di calcio in acqua rilascia calore come solvato di cationi di calcio.Due+ e Cl anioni-. Il CADue+ si circonda di un numero di molecole d'acqua uguale o maggiore di sei (CaDue+-OhDue).
Allo stesso modo, il Cl- è circondato da atomi di idrogeno, la regione δ + dell'acqua (cl--HDueO). Il calore rilasciato può essere utilizzato per sciogliere masse di ghiaccio.
Urea
Nel caso dell'urea, è una molecola organica con struttura HDueN-CO-NHDue. Quando solvatato, le molecole H.DueOppure forma legami idrogeno con i due gruppi amminici (-NHDue-OhDue) e con il gruppo carbonile (C = O-HDueO). Queste interazioni sono responsabili della sua grande solubilità in acqua..
Allo stesso modo, la sua dissoluzione è endotermica, cioè raffredda il contenitore dell'acqua dove viene aggiunta.
Nitrato di ammonio
Il nitrato di ammonio, come l'urea, è un soluto che raffredda la soluzione dopo la solvatazione dei suoi ioni. NH4+ è solvatato in modo simile a CaDue+, anche se probabilmente perché è di geometria tetraedrica ha meno molecole H.DueO intorno a te; e il NO3- è solvatato allo stesso modo degli anioni Cl- (OHDue-ODueNO- HDueO).
Riferimenti
- Glasstone S. (1970). Trattato di chimica e fisica. Aguilar, S.A., Madrid, Spagna.
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Ira N. Levine. (2014). Principi di Fisicochimica. Sesta edizione. Mc Graw Hill.
- Dizionario Chemicool. (2017). Definizione Solvation. Estratto da: chemicool.com
- Belford R. (s.f.). Processi di risoluzione. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Wikipedia. (2018). Solvazione. Estratto da: en.wikipedia.org
- Hardinger A. Steven. (2017). Glossario illustrato di chimica organica: Solvation. Estratto da: chem.ucla.edu
- Surf Guppy. (s.f.). Il processo di risoluzione. Estratto da: surfguppy.com


Nessun utente ha ancora commentato questo articolo.