
Diagramma di Moeller di cosa consiste ed esercizi risolti
Il Diagramma di Moeller o Il metodo Rain è un metodo grafico e mnemonico per apprendere la regola di Madelung; cioè come scrivere la configurazione elettronica di un elemento. È caratterizzato dal disegnare diagonali attraverso le colonne degli orbitali e, seguendo la direzione della freccia, viene stabilito l'ordine appropriato delle stesse per un atomo.
In alcune parti del mondo il diagramma di Moeller è anche noto come metodo della pioggia. Attraverso questo, viene definito un ordine nel riempimento degli orbitali, che sono anche definiti dai tre numeri quantici n, l Y ml.
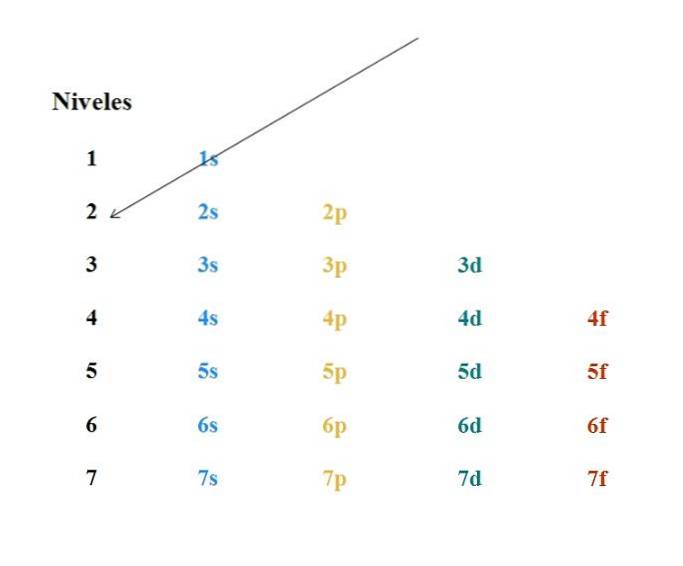
Un semplice diagramma di Moeller è mostrato nell'immagine sopra. Ogni colonna corrisponde a diversi orbitali: s, p, d e f, con i rispettivi livelli di energia. La prima freccia indica che il riempimento di qualsiasi atomo deve iniziare con l'orbitale 1s.
Pertanto, la freccia successiva deve iniziare dall'orbitale 2s e poi dall'orbitale 2p fino all'orbitale 3s. In questo modo, come se fosse una pioggia, gli orbitali e il numero di elettroni che contengono (4l+Due).
Il diagramma di Moeller rappresenta un'introduzione per coloro che studiano le configurazioni elettroniche..
Indice articolo
- 1 Qual è il diagramma di Moeller?
- 1.1 Regola di Madelung
- 1.2 Passaggi da seguire
- 2 Esercizi risolti
- 2.1 Berillio
- 2.2 Fosforo
- 2.3 Zirconio
- 2.4 Iridium
- 2.5 Eccezioni al diagramma di Moeller e alla regola di Madelung
- 3 Riferimenti
Qual è il diagramma di Moeller?
La regola di Madelung
Poiché il diagramma di Moeller consiste in una rappresentazione grafica della regola di Madelung, è necessario sapere come funziona quest'ultima. Il riempimento degli orbitali deve obbedire alle seguenti due regole:
-Gli orbitali con i valori più bassi di n+l sono riempiti per primi, l'essere n il numero quantico principale, e l il momento angolare orbitale. Ad esempio, l'orbitale 3d corrisponde a n= 3 e l= 2, quindi, n+l= 3 + 2 = 5; nel frattempo, l'orbitale 4s corrisponde a n= 4 e l= 0 e n+l= 4 + 0 = 4. Da quanto sopra si stabilisce che gli elettroni riempiono l'orbitale 4s prima di quello 3d.
-Se due orbitali hanno lo stesso valore di n+l, gli elettroni occuperanno prima quello con il valore più basso di n. Ad esempio, l'orbitale 3d ha un valore di n+l= 5, come l'orbitale 4p (4 + 1 = 5); ma poiché 3d ha il valore più piccolo di n, si riempirà prima di 4p.
Dalle due precedenti osservazioni si può raggiungere il seguente ordine di riempimento degli orbitali: 1s 2s 2p 3s 3p 4s 3d 4p.
Seguendo gli stessi passaggi per valori diversi di n+l per ogni orbitale si ottengono le configurazioni elettroniche di altri atomi; che a sua volta può anche essere determinato graficamente dal diagramma di Moeller.
Passi da seguire
La regola di Madelung afferma la formula n+l, con cui è possibile "armare" la configurazione elettronica. Tuttavia, come detto, il diagramma di Moeller lo rappresenta già graficamente; quindi segui le sue colonne e disegna le diagonali passo dopo passo.
Come si avvia quindi la configurazione elettronica di un atomo? Per fare ciò, devi prima conoscere il suo numero atomico Z, che per definizione per un atomo neutro è uguale al numero di elettroni.
Quindi, con Z si ottiene il numero di elettroni, e con questo in mente iniziamo a disegnare diagonali attraverso il diagramma di Moeller.
Gli orbitali s possono ospitare due elettroni (applicando la formula 4l+2), i p sei elettroni, il d dieci e il f quattordici. Si ferma all'orbitale dove è stato occupato l'ultimo elettrone dato da Z..
Per ulteriori chiarimenti, di seguito sono riportati una serie di esercizi risolti.
Esercizi risolti
Berillio
Utilizzando la tavola periodica, l'elemento berillio si trova con una Z = 4; cioè, i suoi quattro elettroni devono essere sistemati negli orbitali.
Partendo quindi dalla prima freccia nel diagramma di Moeller, l'orbitale 1s occupa due elettroni: 1sDue; seguito dall'orbitale 2s, con due elettroni aggiuntivi per aggiungere fino a 4 in totale: 2sDue.
Pertanto, la configurazione elettronica del berillio, espressa come [Be] è 1sDue2sDue. Si noti che la somma degli apici è uguale al numero di elettroni totali.
Incontro
L'elemento fosforo ha Z = 15, e quindi ha 15 elettroni in totale che devono occupare gli orbitali. Per avanzare, inizi subito con l'impostazione 1sDue2sDue, che contiene 4 elettroni. Quindi mancherebbero altri 9 elettroni.
Dopo l'orbitale 2s, la freccia successiva "entra" attraverso l'orbitale 2p, atterrando infine nell'orbitale 3s. Poiché gli orbitali 2p possono occupare 6 elettroni e gli elettroni 3s 2, abbiamo: 1sDue2sDue2 P63sDue.
Mancano ancora altri 3 elettroni, che occupano il seguente orbitale 3p secondo il diagramma di Moeller: 1sDue2sDue2 P63sDue3p3, configurazione elettronica del fosforo [P].
Zirconio
L'elemento zirconio ha una Z = 40. Percorso di accorciamento con setup 1sDue2sDue2 P63sDue3p6, con 18 elettroni (quello del gas nobile argon), mancherebbero altri 22 elettroni. Dopo l'orbitale 3p, i successivi da riempire secondo il diagramma di Moeller sono gli orbitali 4s, 3d, 4p e 5s.
Riempiendoli completamente, cioè 4sDue, 3d10, 4p6 e 5sDue, vengono aggiunti un totale di 20 elettroni. I 2 elettroni rimanenti sono quindi alloggiati nel seguente orbitale: il 4d. Pertanto, la configurazione elettronica dello zirconio, [Zr] è: 1sDue2sDue2 P63sDue3p64sDue3d104p65sDue4dDue.
Iridio
L'iridio ha Z = 77, quindi ha 37 elettroni aggiuntivi rispetto allo zirconio. A partire da [Cd], ovvero 1sDue2sDue2 P63sDue3p64sDue3d104p65sDue4d10, aggiungi 29 elettroni con i seguenti orbitali del diagramma di Moeller.
Disegnando nuove diagonali, i nuovi orbitali sono: 5p, 6s, 4f e 5d. Riempiendo completamente i primi tre orbitali, abbiamo: 5p6, 6sDue e 4f14, per dare un totale di 22 elettroni.
Quindi mancano 7 elettroni, che si trovano nell'orbitale 5d: 1s.Due2sDue2 P63sDue3p64sDue3d104p65sDue4d105 p66sDue4f145 D7.
Quanto sopra è la configurazione elettronica dell'iridio, [Vai]. Nota che gli orbitali 6sDue e 5d7 sono evidenziati in grassetto per indicare che corrispondono correttamente allo strato di valenza di questo metallo.
Eccezioni al diagramma di Moeller e alla regola di Madelung
Ci sono molti elementi nella tavola periodica che non obbediscono a quanto appena spiegato. Le loro configurazioni elettroniche differiscono sperimentalmente da quelle previste per ragioni quantistiche..
Tra gli elementi che presentano queste discrepanze ci sono: cromo (Z = 24), rame (Z = 29), argento (Z = 47), rodio (Z = 45), cerio (Z = 58), niobio (Z = 41) e tanti altri.
Le eccezioni sono molto frequenti nel riempimento degli orbitali de f. Ad esempio, chrome dovrebbe avere un'impostazione di valenza di 4sDue3d4 secondo il diagramma di Moeller e la regola di Madelung, ma in realtà è 4s13d5.
Inoltre, e infine, l'impostazione della valenza d'argento dovrebbe essere 5sDue4d9; ma è davvero 5s14d10.
Riferimenti
- Gavira J. Vallejo M. (6 agosto 2013). Eccezioni alla regola di Madelung e al diagramma di Moeller nella configurazione elettronica degli elementi chimici. Estratto da: triplenlace.com
- La mia superclasse. (s.f.) Cos'è la configurazione elettronica? Estratto da: misuperclase.com
- Wikipedia. (2018). Diagramma di Moeller. Estratto da: es.wikipedia.org
- Manichini. (2018). Come rappresentare gli elettroni in un diagramma del livello di energia. Estratto da: dummies.com
- Nave R. (2016). Ordine di riempimento degli stati elettronici. Estratto da: hyperphysics.phy-astr.gsu.edu


Nessun utente ha ancora commentato questo articolo.