
Struttura, sintesi, proprietà e usi dell'acido picrico
Il acido picrico è un composto chimico organico altamente nitrato il cui nome IUPAC è 2,4,6-trinitrofenolo. La sua formula molecolare è C6HDue(NONDue)3OH. È un fenolo molto acido e può essere trovato come picrato di sodio, ammonio o potassio; cioè nella sua forma ionica C6HDue(NONDue)3ONa.
È un solido con un forte sapore amaro, e da qui deriva il suo nome, dalla parola greca "prikos", che significa amaro. Si trova sotto forma di cristalli gialli bagnati. Il suo essiccamento o disidratazione è pericoloso, poiché aumenta le proprietà instabili che lo rendono esplosivo.
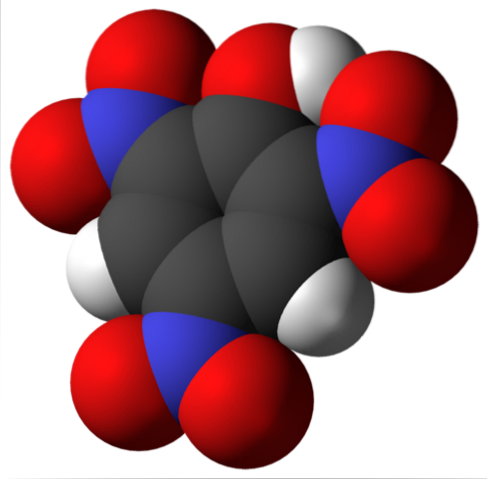
La molecola di acido picrico è mostrata sopra. Nell'immagine è difficile riconoscere i legami e gli atomi perché questo corrisponde alla rappresentazione della sua superficie di Van der Waals. La sezione successiva affronta la struttura molecolare in maggiore dettaglio..
Alcuni composti intermedi, vari sali di picrato e complessi di acido picrico vengono sintetizzati dall'acido picrico..
L'acido picrico è utilizzato come base per la sintesi di coloranti gialli permanenti. Alcuni patologi e ricercatori lo usano nella fissazione o colorazione di sezioni di tessuto e altri processi immunoistochimici..
È molto utile nella fabbricazione di prodotti farmaceutici. Inoltre, viene utilizzato nella produzione di fiammiferi ed esplosivi. Viene anche utilizzato per incidere metalli, per produrre vetri colorati e nella determinazione colorimetrica di parametri biologici come la creatinina..
L'acido picrico è invece irritante quando viene a contatto con la pelle, la mucosa respiratoria, oculare e digestiva. Oltre a danneggiare la pelle, può danneggiare gravemente i reni, il sangue e il fegato, tra gli altri organi..
Indice articolo
- 1 Struttura
- 1.1 Fenolo acido
- 1.2 Struttura cristallina
- 2 Sintesi
- 2.1 Nitrazione fenolica diretta
- 3 Proprietà fisiche e chimiche
- 3.1 Peso molecolare
- 3.2 Aspetto fisico
- 3.3 Odore
- 3.4 Aroma
- 3.5 Punto di fusione
- 3.6 Punto di ebollizione
- 3.7 Densità
- 3.8 Solubilità
- 3.9 Corrosività
- 3.10 pKa
- 3.11 Instabilità
- 4 Usi
- 4.1 Ricerca
- 4.2 Chimica organica
- 4.3 Nell'industria
- 4.4 Applicazioni militari
- 5 Tossicità
- 6 Riferimenti
Struttura

L'immagine in alto mostra tutti i legami e la struttura stessa della molecola di acido picrico in modo più dettagliato. È costituito da un fenolo con tre sostituenti nitro.
Si può vedere che nei gruppi NODue l'atomo di azoto ha una carica parziale positiva e quindi richiede la densità elettronica dei suoi dintorni. Ma l'anello aromatico attrae anche gli elettroni verso se stesso e prima dei tre NODue finisce per rinunciare a parte della propria densità elettronica.
In conseguenza di ciò, l'ossigeno del gruppo OH tende maggiormente a condividere una delle sue coppie elettroniche libere per sopperire alla deficienza elettronica subita dall'anello; e così facendo si forma il legame C = O+-H. Questa carica positiva parziale sull'ossigeno indebolisce il legame O-H e aumenta l'acidità; cioè, verrà rilasciato come ione idrogeno, H+.
Fenolo acido
È per questo motivo che questo composto è un acido eccezionalmente forte (e reattivo), ancor più dell'acido acetico stesso. Tuttavia, il composto è in realtà un fenolo la cui acidità supera quella degli altri fenoli; dovuto, come appena accennato, ai sostituenti NODue.
Pertanto, poiché è un fenolo, il gruppo OH ha la priorità e dirige l'enumerazione nella struttura. I tre NODue si trovano ai carboni 2, 4 e 6 dell'anello aromatico rispetto all'OH. Da qui deriva la nomenclatura IUPAC per questo composto: 2,4,6-Trinitrofenolo (TNP).
Se i gruppi non c'erano, NODue, o se ce ne fosse un numero minore nell'anello, il legame O-H si indebolirebbe di meno, e quindi il composto avrebbe meno acidità.
Struttura di cristallo
Le molecole di acido picrico sono disposte in modo tale da favorire le loro interazioni intermolecolari; sia per la formazione di legami idrogeno tra i gruppi OH e NODue, forze dipolo-dipolo o repulsioni elettrostatiche tra regioni carenti di elettroni.
Ci si potrebbe aspettare che i gruppi NON lo farannoDue si respingevano a vicenda e si orientavano in direzione degli anelli aromatici vicini. Inoltre, gli anelli non sarebbero in grado di allinearsi uno sopra l'altro a causa dell'aumento delle repulsioni elettrostatiche..
Prodotto di tutte queste interazioni, l'acido picrico riesce a formare una rete tridimensionale che definisce un cristallo; la cui cella unitaria corrisponde a un sistema cristallino di tipo ortorombico.
Sintesi
Inizialmente, è stato sintetizzato da composti naturali come derivati del corno animale, resine naturali, tra gli altri. A partire dal 1841, il fenolo è stato utilizzato come precursore dell'acido picrico, seguendo vari percorsi o attraverso vari procedimenti chimici.
Come già accennato, è uno dei fenoli più acidi. Per sintetizzarlo, il fenolo subisce prima un processo di solfonazione, seguito da un processo di nitrazione..
La solfonazione del fenolo anidro viene effettuata trattando il fenolo con acido solforico fumante, producendo sostituzioni elettrofile aromatiche di H da gruppi solfonati, SO3H, in posizione -orto e -para rispetto al gruppo OH.
Questo prodotto, acido 2,4-fenoldisolfonico, subisce il processo di nitrazione, trattandolo con acido nitrico concentrato. In tal modo, i due gruppi SO3H sono sostituiti da gruppi nitro, NODue, e un terzo entra nell'altra posizione nitro. La seguente equazione chimica lo illustra:
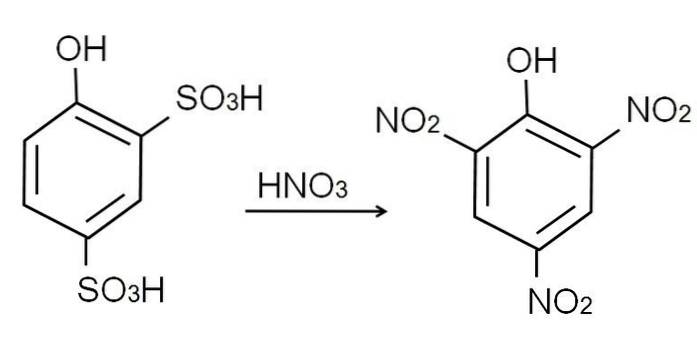
Nitrazione fenolica diretta
Il processo di nitrazione fenolica non può essere effettuato direttamente, poiché si generano catrami ad alto peso molecolare. Questo metodo di sintesi necessita di un controllo molto attento della temperatura poiché è molto esotermico:
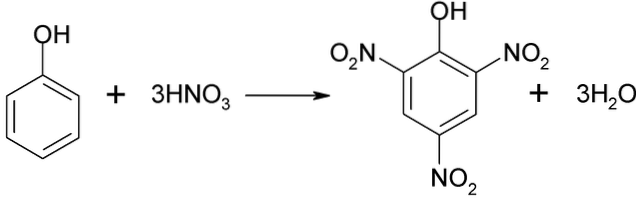
L'acido picrico può essere ottenuto effettuando il processo di nitrazione diretta del 2,4-dinitrofenolo, con acido nitrico.
Un altro modo di sintesi è trattare il benzene con acido nitrico e nitrato mercurico..
Proprietà fisiche e chimiche
Peso molecolare
229,104 g / mol.
Aspetto fisico
Massa gialla o sospensione di cristalli bagnati.
Odore
È inodore.
Gusto
È molto amaro.
Punto di fusione
122,5 ° C.
Punto di ebollizione
300 ° C. Ma, quando si scioglie, esplode.
Densità
1,77 g / mL.
Solubilità
È un composto moderatamente solubile in acqua. Questo perché i suoi gruppi OH e NODue possono interagire con le molecole d'acqua attraverso legami idrogeno; sebbene l'anello aromatico sia idrofobo e quindi ne comprometta la solubilità.
Corrosività
L'acido picrico è generalmente corrosivo per i metalli, ad eccezione dello stagno e dell'alluminio.
pKa
0.38. È un forte acido organico.
Instabilità
L'acido picrico è caratterizzato da proprietà instabili. Costituisce un rischio per l'ambiente, è instabile, esplosivo e tossico.
Deve essere conservato ben chiuso per evitare la disidratazione, poiché l'acido picrico è molto esplosivo se lasciato asciugare. Bisogna fare molta attenzione con la sua forma anidra, perché è molto sensibile all'attrito, agli urti e al calore..
L'acido picrico deve essere conservato in luoghi freschi e ventilati, lontano da materiali ossidabili. È irritante a contatto con la pelle e le mucose, non deve essere ingerito ed è tossico per il corpo.
Applicazioni
L'acido picrico è stato ampiamente utilizzato nella ricerca, nella chimica, nell'industria e nell'esercito..
Indagine
Quando viene utilizzato come fissativo per cellule e tessuti, migliora i risultati della colorazione di questi con coloranti acidi. Succede con metodi di colorazione tricromica. Dopo aver fissato il tessuto con formalina, si consiglia una nuova fissazione con acido picrico..
In questo modo viene garantita una colorazione intensa e molto brillante dei tessuti. Non si ottengono buoni risultati con i coloranti di base. Tuttavia, è necessario prendere precauzioni, poiché l'acido picrico può idrolizzare il DNA se lasciato troppo a lungo..
Chimica organica
-In chimica organica viene utilizzato come picrato alcalino per effettuare l'identificazione e l'analisi di varie sostanze.
-È utilizzato nella chimica analitica dei metalli.
-Nei laboratori clinici è utilizzato nella determinazione dei livelli di creatinina sierica e urinaria..
-È stato anche utilizzato in alcuni dei reagenti utilizzati per l'analisi dei livelli di glucosio..
Nell'industria
-A livello dell'industria fotografica, l'acido picrico è stato utilizzato come sensibilizzante nelle emulsioni fotografiche. Ha fatto parte della produzione di prodotti come pesticidi, potenti insetticidi, tra gli altri.
-L'acido picrico viene utilizzato per sintetizzare altri intermedi chimici come la cloropicrina e l'acido picramico, ad esempio. Alcuni medicinali e coloranti per l'industria della pelle sono stati realizzati con questi composti..
-L'acido picrico è stato utilizzato nel trattamento delle ustioni, come antisettico e altre condizioni, prima che la sua tossicità diventasse evidente.
-Componente importante per la sua natura esplosiva nella fabbricazione di fiammiferi e batterie.
Applicazioni militari
-A causa dell'elevata esplosività dell'acido picrico, è stato utilizzato negli impianti di munizioni per armi militari.
-L'acido picrico pressato e fuso è stato utilizzato in proiettili di artiglieria, granate, bombe e mine.
-Il sale di ammonio dell'acido picrico è stato usato come esplosivo, è molto potente ma meno stabile del TNT. Per un certo periodo è stato utilizzato come componente del carburante per missili.
Tossicità
È stato dimostrato che è molto tossico per il corpo umano e in generale per tutti gli esseri viventi.
Si raccomanda di evitare l'inalazione e l'ingestione, a causa della sua tossicità orale acuta. Inoltre provoca la mutazione nei microrganismi. Ha effetti tossici sulla fauna selvatica, sui mammiferi e sull'ambiente in generale.
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Wikipedia. (2018). Acido picrico. Estratto da: en.wikipedia.org
- Università di Purdue. (2004). Esplosione di acido picrico. Estratto da: chemed.chem.purdue.edu
- Progetto cristallografia 365. (10 febbraio 2014). Meno che giallo dolce - la struttura dell'acido picrico. Estratto da: crystallography365.wordpress.com
- PubChem. (2019). Acido picrico. Estratto da: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Acido picrico. Methuen, Londra, Regno Unito.


Nessun utente ha ancora commentato questo articolo.