
Struttura, proprietà, sintesi dell'acido nitroso (HNO2)

Il acido nitroso è un acido debole, inorganico, la cui formula chimica è HNODue. Si trova principalmente in soluzione acquosa di colore azzurro pallido. È molto instabile e si decompone rapidamente in ossido nitrico, NO e acido nitrico, HNO3.
Di solito si trova in soluzione acquosa sotto forma di nitriti. Inoltre proviene naturalmente dall'atmosfera a seguito della reazione dell'ossido nitrico con l'acqua. Lì, in particolare nella troposfera, l'acido nitroso interviene nella regolazione della concentrazione di ozono.

Una soluzione HNO è mostrata nell'immagine sopraDue dove si apprezza il caratteristico colore azzurro chiaro di questo acido. È sintetizzato dalla dissoluzione del triossido di azoto, NDueO3, in acqua. Allo stesso modo, è il prodotto dell'acidificazione di soluzioni di nitrito di sodio a basse temperature..
L'HNODue Ha poco uso commerciale, essendo utilizzato sotto forma di nitrito nella conservazione della carne. D'altra parte, è utilizzato nella produzione di coloranti azoici.
Viene utilizzato, insieme al tiosolfato di sodio, nel trattamento di pazienti con avvelenamento da cianuro di sodio. Ma è un agente mutageno e si pensa che possa causare sostituzioni nelle basi delle catene del DNA, attraverso una deaminazione ossidativa di citosina e adenina..
L'acido nitroso ha un duplice comportamento, poiché può comportarsi come agente ossidativo o come agente riducente; cioè, può essere ridotto a NO o NDue, u ossidare a HNO3.
Indice articolo
- 1 Struttura dell'acido nitroso
- 2 Proprietà
- 2.1 Nomi chimici
- 2.2 Descrizione fisica
- 2.3 Peso molecolare
- 2.4 Costante di dissociazione
- 2.5 Punto di fusione
- 2.6 Punto di ebollizione
- 2.7 Formazione del sale
- 2.8 Potenziale di fuoco
- 2.9 Decomposizione
- 2.10 Agente riducente
- 2.11 Agente ossidante
- 3 Nomenclatura
- 4 Sintesi
- 5 Rischi
- 6 Usi
- 6.1 Produzione di sali di diazonio
- 6.2 Rimozione della sodio azide
- 6.3 Sintesi di ossime
- 6.4 Nella sua forma salina
- 7 Riferimenti
Struttura dell'acido nitroso
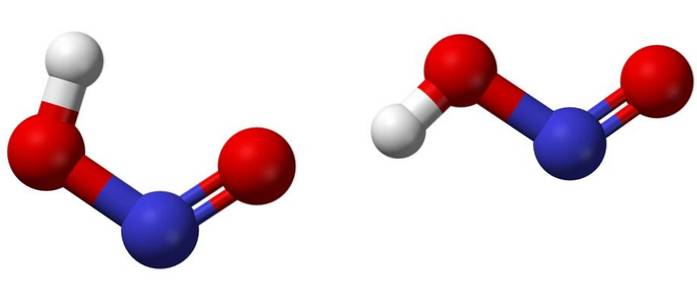
L'immagine in alto mostra la struttura molecolare dell'acido nitroso utilizzando un modello di sfere e bacchette. L'atomo di azoto (sfera blu) si trova al centro della struttura, formando un doppio legame (N = O) e un legame singolo (N-O) con gli atomi di ossigeno (sfere rosse).
Notare che l'atomo di idrogeno (sfera bianca) è legato a uno degli ossigeni e non direttamente all'azoto. Quindi, sapendo questo, la formula strutturale di HNODue è [HO-N = O] o [NO (OH)] e non esiste alcun legame H-N (come potrebbe suggerire la formula chimica).
Le molecole nell'immagine corrispondono a quelle di una fase gassosa; in acqua sono circondati da molecole d'acqua, che possono accettare lo ione idrogeno (debolmente) per formare NO ioniDue- e H.3O+.
Le loro strutture possono assumere due forme: cis o trans, chiamate isomeri geometrici. Nell'isomero cis, l'atomo H è eclissato dal vicino atomo di ossigeno; mentre nell'isomero trans, entrambi sono in posizione anti o opposta.
Nell'isomero cis è probabile la formazione di un ponte idrogeno intramolecolare (OH-NO) che può disturbare quelli intermolecolari (ONOH-ONOH)..
Proprietà
Nomi chimici
-Acido nitroso
-Acido diossonitrico (III)
-Idrossido di nitrosile
-Idrossido ossidonitrogeno (nome sistematico IUPAC)
Descrizione fisica
Liquido blu pallido, corrispondente alla soluzione di nitrito.
Peso molecolare
47,013 g / mol.
Costante di dissociazione
È un acido debole. Il suo pKa è 3,35 a 25 ºC.
Punto di fusione
È noto solo in soluzione. Pertanto, il suo punto di fusione non può essere calcolato, né i suoi cristalli possono essere isolati..
Punto di ebollizione
Poiché non esiste puro ma in acqua, le misurazioni di questa proprietà non sono precise. Da un lato, dipende dalla concentrazione di HNODue, e dall'altro il suo riscaldamento produce la sua decomposizione. Questo è il motivo per cui non viene riportato un punto di ebollizione esatto..
Formazione di sale
Forma nitriti idrosolubili con Li+, N / A+, K+, ACDue+, SigDue+, BaDue+. Ma non forma sali con cationi polivalenti, come: Al3+ e / o BeDue+ (a causa della sua elevata densità di carica). È in grado di formare esteri stabili con alcoli.
Potenziale di fuoco
È infiammabile per reazioni chimiche. Può esplodere a contatto con il tricloruro di fosforo.
Decomposizione
È un composto molto instabile e in soluzione acquosa si decompone in ossido nitrico e acido nitrico:
2 HNODue => NODue + NO + HDueO
4 HNODue => 2 HNO3 + NDueO + HDueO
Agente riducente
L'acido nitroso in soluzione acquosa si presenta sotto forma di ioni nitrito, NODue-, che subiscono varie reazioni di riduzione.
Reagisce con I ioni- e la fedeDue+, sotto forma di nitrito di potassio, per formare ossido nitrico:
2 KNODue + KI + HDueSW4 => IDue + 2 NO + 2 HDueO + KDueSWDue
Il nitrito di potassio in presenza di ioni di stagno viene ridotto per formare protossido di azoto:
KNODue + 6 HCl + 2 SnClDue => 2 SnCl4 + NDueO + 3 HDueO + 2 KCl
Il nitrito di potassio viene ridotto dallo Zn in un mezzo alcalino, formando ammoniaca:
5 hDueO + KNODue + 3 Zn => NH3 + KOH + 3 Zn (OH)Due
Agente ossidante
Oltre ad essere un agente riducente, l'acido nitroso può intervenire nei processi di ossidazione. Ad esempio: ossida l'idrogeno solforato, trasformandosi in ossido nitrico o ammoniaca, a seconda dell'acidità del mezzo in cui avviene la reazione.
2 HNODue + HDueS => S + 2 NO + 2 HDueO
HNODue + 3 oreDueS => S + NH3 + 2 hDueO
L'acido nitroso, in un mezzo a pH acido, può ossidare lo ione ioduro in iodio.
HNODue + io- + 6 h+ => 3 IDue + NH3 + 2 hDueO
Può anche agire come agente riducente agendo sul CuDue+, dando origine all'acido nitrico.
Nomenclatura
All'HNODue Può essere dato altri nomi, che dipendono dal tipo di nomenclatura. L'acido nitroso corrisponde alla nomenclatura tradizionale; acido diossonitrico (III), alla nomenclatura stock; e diossonitrato di idrogeno (III), alla sistematica.
Sintesi
L'acido nitroso può essere sintetizzato sciogliendo il triossido di azoto in acqua:
NDueO3 + HDueO => 2 HNODue
Un altro metodo di preparazione consiste nella reazione del nitrito di sodio, NaNO3, con acidi minerali; come l'acido cloridrico e l'acido bromidrico. La reazione viene condotta a bassa temperatura e l'acido nitroso viene consumato in situ..
Fratello maggiore3 + H+ => HNODue + N / A+
Lo ione H.+ proviene da HCl o HBr.
Rischi
Date le sue proprietà e caratteristiche chimiche, ci sono poche informazioni sugli effetti tossici diretti dell'HNO.Due. Forse alcuni effetti dannosi che si ritiene siano prodotti da questo composto sono in realtà causati dall'acido nitrico, che può essere prodotto dalla scomposizione dell'acido nitroso.
Si noti che HNODue può avere effetti dannosi sul tratto respiratorio ed essere in grado di produrre sintomi irritanti nei pazienti asmatici.
Sotto forma di nitrito di sodio, viene ridotto dalla deossiemoglobina, producendo ossido nitrico. Questo è un potente vasodilatatore che produce il rilassamento della muscolatura liscia vascolare, stimando una dose LD50 di 35 mg / kg per il consumo orale nell'uomo..
La tossicità del nitrito di sodio si manifesta con collasso cardiovascolare, seguito da grave ipotensione, dovuta all'azione vasodilatatrice dell'ossido nitrico, prodotto dal nitrito..
Biossido di azoto, NODue, presente nell'aria inquinata (smog), in determinate condizioni può provocare acido nitroso; che, a loro volta, possono reagire con le ammine per formare nitrosammine, una gamma di composti cancerogeni.
Una reazione simile si verifica con il fumo di sigaretta. Sono stati trovati residui di nitrosamina aderenti al rivestimento interno dei veicoli per fumatori.
Applicazioni
Produzione di sali di diazonio
L'acido nitroso è utilizzato nell'industria nella produzione di sali di diazonio, attraverso la sua reazione con ammine aromatiche e fenoli.
HNODue + ArNHDue + H+ => ArN = NAr + HDueO
I sali di diazonio sono usati nelle reazioni di sintesi organica; per esempio, nella reazione di Sandmeyer. In questa reazione, la sostituzione di un gruppo amminico (H.DueN-), in un'ammina aromatica primaria, dai gruppi Cl-, Br- e CN-. Per ottenere questi prodotti aromatici sono necessari sali rameosi.
I sali di diazonio possono formare composti azoici luminosi che vengono utilizzati come coloranti e servono anche come test qualitativo per la presenza di ammine aromatiche..
Rimozione di sodio azide
L'acido nitroso viene utilizzato per la rimozione della sodio azide (NaN3), potenzialmente pericoloso per la sua tendenza ad esplodere.
2 NaN3 + 2 HNODue => 3 NDue + 2 NO + 2 NaOH
Sintesi di ossime
L'acido nitroso può reagire con i gruppi chetonici per formare ossime. Questi possono essere ossidati per formare acidi carbossilici o ridotti per formare ammine..
Questo processo viene utilizzato nella preparazione commerciale dell'acido adipico, il monomero utilizzato nella produzione del nylon. È anche coinvolta nella produzione di poliuretano ei suoi esteri sono plastificanti, principalmente PVC.
Nella sua forma salina
L'acido nitroso, sotto forma di nitrito di sodio, è utilizzato nel trattamento e nella conservazione della carne; poiché impedisce la crescita batterica ed è in grado di reagire con la mioglobina, producendo un colore rosso scuro che rende la carne più appetibile per il consumo.
Questo stesso sale viene utilizzato, insieme al tiosolfato di sodio, nel trattamento endovenoso dell'avvelenamento da cianuro di sodio..
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- PubChem. (2019). Acido nitroso. Estratto da: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Acido nitroso. Estratto da: Softschools.com
- Wikipedia. (2019). Acido nitroso. Estratto da: en.wikipedia.org
- Royal Society of Chemistry. (2015). Acido nitroso. Estratto da: chemspider.com
- New World Encyclopedia. (2015). Acido nitroso. Estratto da: newworldencyclopedia.org
- DrugBank. (2019). Acido nitroso. Estratto da: drugbank.ca
- Formulazione chimica. (2018). HNODue. Estratto da: formulacionquimica.com



Nessun utente ha ancora commentato questo articolo.