
Formula, proprietà e usi dell'acido ipoiodico (HIO)

Il acido ipoiodico, noto anche come monoxoiodato di idrogeno (I) o iodolo, è un composto inorganico di formula HIO. È un ossacido di iodio, con un atomo di ossigeno, un atomo di idrogeno e un atomo di iodio con uno stato di ossidazione di 1+.
Il composto è molto instabile poiché tende a subire una reazione di dismutazione dove viene ridotto a iodio molecolare e ossidato ad acido iodico secondo la reazione: 5HIO → 2IDue + HIO3 + 2HDueO.
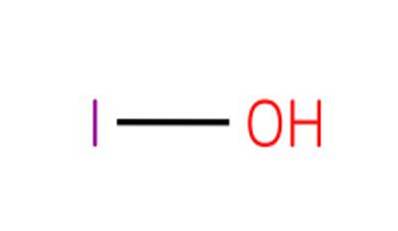
Il composto è l'acido più debole degli ossacidi alogeni allo stato di ossidazione 1+. I sali corrispondenti di questo acido sono noti come ipoioditi.
Questi sali sono più stabili dell'acido e si formano in modo simile alle loro controparti di cloro e bromo, facendo reagire lo iodio molecolare con idrossidi di metalli alcalini o alcalino terrosi..
L'acido di iodio è prodotto facendo reagire lo iodio molecolare con l'ossido di mercurio (II) (Egon Wiberg, 2001) secondo la reazione:
2IDue + 3HgO + HDueO → 2HIO + HgIDue ● 2HgO
Tracce del composto si ottengono anche facendo reagire lo iodio molecolare con idrossido di potassio per formare, inizialmente ioduro di potassio e ipoiodito di potassio secondo la reazione:
ioDue + 2KOH → KI + KIO
Tuttavia, l'acido ipoiodico, essendo un acido così debole, rende possibile l'idrolizzazione dell'ipoiodito di potassio a meno che non vi sia un eccesso di idrossido di potassio (Holmyard, 1922).
KIO + HDueO → HIO + KOH
Può anche essere ottenuto, come le sue controparti cloro e bromo, facendo reagire lo iodio molecolare con l'acqua. Tuttavia, data la sua bassa costante di equilibrio, che è dell'ordine di 10-13, le quantità ottenute sono molto piccole (R.G. Compton, 1972).
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche
L'acido ipoiodico esiste solo come soluzione acquosa di colore giallastro. Il composto allo stato solido non è stato isolato, quindi la maggior parte delle sue proprietà sono teoricamente ottenute tramite calcoli computazionali (National Center for Biotechnology Information, 2017).
L'acido di iodio ha un peso molecolare di 143,911 g / mol, un punto di fusione di 219,81 ° C, un punto di ebollizione di 544,27 ° C e una tensione di vapore di 6,73 x 10-14 millimetri di mercurio.
La molecola è molto solubile in acqua, potendo dissolversi tra 5,35 x 105 e 8,54 x 105 grammi di composto per litro di questo solvente (Royal Society of Chemistry, 2015).
HOI è un forte ossidante e può formare miscele esplosive. È anche un agente riducente e può essere ossidato nelle forme iodiche, iodiche e periodiche dell'acido. In soluzioni acquose, essendo un acido debole, si dissocia parzialmente nello ione ipoiodito (OI-) e H.+.
HOI reagisce con le basi per formare sali chiamati ipoioditi. Ad esempio, l'ipoiodito di sodio (NaOI) si forma facendo reagire l'acido di ipoiodio con l'idrossido di sodio..
HOI + NaOH → NaOI + HDueO
L'acido di ipoiodio reagisce anche facilmente con una varietà di molecole organiche e biomolecole..
Reattività e rischi
L'acido di ipoiodio è un composto instabile che si decompone in iodio elementare. Lo iodio è un composto tossico che deve essere maneggiato con cura.
L'acido ipoiodico è pericoloso in caso di contatto con la pelle (irritante), a contatto con gli occhi (irritante) e in caso di ingestione e inalazione.
In caso di contatto con gli occhi, controllare se si indossano lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, tenendo le palpebre aperte. È possibile utilizzare acqua fredda. Unguento per gli occhi non deve essere utilizzato.
Se la sostanza chimica viene a contatto con gli indumenti, rimuoverla il più rapidamente possibile, proteggendo le mani e il corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula sulla pelle esposta della vittima, come le mani, la pelle contaminata viene lavata delicatamente e accuratamente con acqua corrente e sapone non abrasivo. È possibile utilizzare acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare gli indumenti contaminati prima di riutilizzarli.
Se il contatto con la pelle è grave, deve essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
In caso di inalazione, consentire alla vittima di riposare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il prima possibile. Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta.
Se la vittima ha difficoltà a respirare, deve essere somministrato ossigeno. Se la vittima non respira, viene eseguita la rianimazione bocca a bocca. Tenere sempre presente che può essere pericoloso per la persona che fornisce assistenza eseguire la rianimazione bocca a bocca quando il materiale inalato è tossico, infettivo o corrosivo..
In caso di ingestione, non provocare il vomito. Allenta indumenti stretti come colletti di camicie, cinture o cravatte. Se la vittima non respira, eseguire la rianimazione bocca a bocca.
In tutti i casi, consultare immediatamente un medico..
Applicazioni
L'acido ipoiodico è usato come potente agente ossidante e come agente riducente nelle reazioni di laboratorio. Viene utilizzato per produrre composti chimici noti come ipoioditi..
I metodi spettrofotometrici sono utilizzati anche per misurare la formazione di acido ipoiodico per monitorare le reazioni in cui è coinvolto lo iodio (T. L. Allen, 1955).
Gli alogenuri vengono incorporati negli aerosol, dove iniziano la distruzione catalitica dell'ozono (O3) sugli oceani e influenzano la troposfera globale. Due intriganti problemi ambientali oggetto di ricerca in corso sono: capire come gli alogeni molecolari nella fase gassosa reattiva vengono prodotti direttamente da alogenuri inorganici esposti a O3 e limitare i fattori ambientali che controllano questo processo interfacciale.
Nel lavoro di (Elizabeth A. Pillar, 2013), la conversione dello ioduro in acido ipoiodico mediante l'azione dell'ozono è stata misurata attraverso misurazioni di spettroscopia di massa per determinare un modello di esaurimento dell'ozono nell'atmosfera..
Riferimenti
- Egon Wiberg, N. W. (2001). Chimica inorganica. Londra: stampa accademica.
- Elizabeth A. Pillar, M. I. (2013). Conversione di ioduro in acido ipoideo e iodio in microgocce acquose esposte all'ozono. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5 gennaio). acido ipoideo. Estratto da ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Chimica inorganica. Londra: Edwar Arnol & co.
- National Center for Biotechnology Information ... (2017, 22 aprile). Database composto di PubChem; CID = 123340. Estratto da PubChem.
- G. Compton, C. B. (1972). Reazioni di composti inorganici non metallici. Ansterdam: Elsevier Publishing Company.
- Royal Society of Chemistry. (2015). Iodol. Estratto da chemspider.com.
- L. Allen, R. M. (1955). La formazione di acido ipoideo e catione di iodio idrato dall'idrolisi dello iodio. J. Am. Chem. Soc., 77 (11) , 2957-2960.



Nessun utente ha ancora commentato questo articolo.