
Struttura, proprietà, usi, sintesi del solfato di potassio (K2SO4)

Il solfato di potassio è un sale inorganico bianco o incolore la cui formula chimica è K.DueSW4. Era già noto nel XIV secolo, essendo chiamato nel XVII secolo come sale duplicatum, poiché è una combinazione di un sale acido e un sale alcalino..
Il solfato di potassio si trova in forma minerale nell'arcanite, ma la sua presentazione è più comune nei cosiddetti sali di Stassfurt. Si tratta di co-cristallizzazioni di solfati di potassio, magnesio, calcio e sodio, osservabili in minerali come leonite e polialogenite..

Il solfato di potassio è un sale a bassa tossicità e provoca irritazione solo a contatto con gli occhi, le vie respiratorie o il tratto digerente. Non ci sono prove di un'azione cancerogena o mutagena.
Il solfato di potassio viene utilizzato come fertilizzante, soprattutto nelle colture sensibili ai cloruri; è il caso del tabacco e delle patate. Il composto fornisce potassio, uno dei tre principali nutrienti nelle piante, e zolfo, che è presente nelle loro proteine..
Indice articolo
- 1 Struttura
- 1.1 Fasi cristalline
- 1.2 Groviglio di ioni
- 2 Proprietà fisiche e chimiche
- 2.1 Nomi
- 2.2 Massa molare
- 2.3 Aspetto fisico
- 2.4 Densità
- 2.5 Punto di fusione
- 2.6 Punto di ebollizione
- 2.7 Solubilità in acqua
- 2.8 Solubilità in solventi organici
- 2.9 Indice di rifrazione (nD)
- 2.10 Reattività
- 3 Sintesi
- 3.1 Primo metodo
- 3.2 Secondo metodo
- 3.3 Terzo metodo
- 3.4 Quarto metodo
- 4 Usi
- 4.1 Fertilizzante
- 4.2 Uso industriale e come materia prima
- 4.3 Medicina
- 4.4 Veterinario
- 4.5 Aromi alimentari
- 4.6 Altri usi
- 5 Rischi
- 6 Riferimenti
Struttura
Fasi cristalline
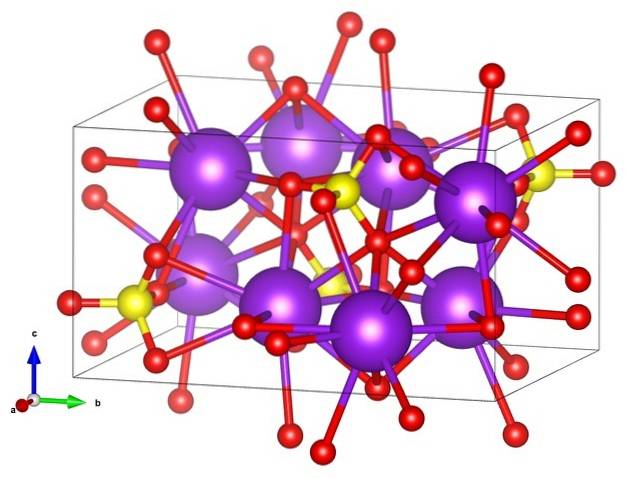
Nella prima immagine è stata mostrata la formula strutturale del solfato di potassio. Per ogni SO anione4Due-, di geometria tetraedrica, ci sono due cationi K+, che può essere rappresentato da sfere viola (immagine in alto).
Quindi sopra abbiamo la struttura cristallina ortorombica di KDueSW4, con SO anioni4Due- rappresentato da sfere gialle e rosse; mentre i cationi K.+, già detto, sono le sfere viola (un po 'più robuste).
Questa rappresentazione può creare confusione se si pensa che le barre corrispondano realmente ai collegamenti di coordinamento. Piuttosto, indicano quale ione interagisce direttamente o strettamente con un altro che lo circonda. Questo è il motivo per cui ogni ossigeno "si collega" con cinque K+ (O3SWDue-- K+), e questi a loro volta con dieci ossigeni da altri anioni solfato circostanti.
C'è poi una sfera di coordinazione un po '"rara" per il potassio in KDueSW4:
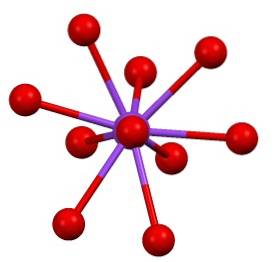
Questa struttura cristallina corrisponde al polimorfo β-KDueSW4. Quando viene riscaldato a 583 ºC, si verifica una transizione alla fase α-KDueSW4, che è esagonale.
Groviglio di ioni
Certamente la struttura di KDueSW4 è insolitamente complicato per un sale inorganico. I suoi ioni si posizionano formando una sorta di groviglio insignificante e, ad occhio nudo, privo di periodicità.
Chi si dedica alla cristallografia può avvicinarsi a questo groviglio in modo più appropriato e descrittivo, osservandolo dai tre assi spaziali.
Nota che la sua struttura aggrovigliata potrebbe spiegare perché il KDueSW4 non forma idrati: molecole H.DueOppure non hanno modo di penetrare nel reticolo cristallino per idratare i cationi di potassio.
Inoltre, con così tante interazioni comprese nel groviglio ionico, ci si può aspettare che questo reticolo cristallino abbia una certa stabilità contro il calore; e infatti questo è il caso, poiché il punto di fusione di KDueSW4 è 1.069 ºC, il che mostra che i suoi ioni sono fortemente coesivi.
Proprietà fisiche e chimiche

Nomi
-Solfato di potassio
-Solfato di potassio
-Arcanite
-Potassa di zolfo
Massa molare
174,259 g / mol
Aspetto fisico
Solido cristallino, granulato o polvere bianco, inodore, dal sapore amaro.
Densità
2,66 g / cm3
Punto di fusione
1.069 ºC
Punto di ebollizione
1.689 ºC
Solubilità dell'acqua
111 g / L a 20 ºC
120 g / L a 25 ºC
240 g / L a 100 ºC
La solubilità in acqua diminuisce a causa della presenza di cloruro di potassio, KCl o solfato di ammonio, (NH4)DueSW4, a causa dell'effetto ionico comune.
Solubilità in solventi organici
Leggermente solubile in glicerolo, ma insolubile in acetone e solfuro di carbonio.
Indice di rifrazione (nD)
1.495
Reattività
Il solfato di potassio può reagire con l'acido solforico, acidificandosi per formare bisolfato di potassio (KHSO4). Può essere ridotto ad alte temperature a solfuro di potassio (KDueS).
Sintesi
Primo metodo
Il solfato di potassio viene sintetizzato facendo reagire il cloruro di potassio con l'acido solforico. La sintesi del solfato di potassio avviene in due fasi. Il primo passaggio prevede la formazione di bisolfato di potassio.
Questa è una reazione esotermica in quanto rilascia calore e quindi non richiede un apporto di calore esterno. La reazione viene condotta a temperatura ambiente.
KCl + HDueSW4 => HCl + KHSO4
La seconda fase della reazione è endotermica, cioè richiede l'apporto di calore affinché possa avvenire.
KCl + KHSO4 => HCl + KDueSW4
Secondo metodo
Il solfato di potassio può essere sintetizzato dalla reazione di neutralizzazione dell'acido solforico con una base, l'idrossido di potassio:
HDueSW4 + 2 KOH => KDueSW4 + 2 hDueO
Terzo metodo
Il solfato di potassio è prodotto dalla reazione di anidride solforosa, ossigeno, cloruro di potassio e acqua.
Quarto metodo
Il solfato di potassio viene prodotto estraendo il solfato di potassio presente in una salamoia dal bacino di Loop Nur, in Cina. Il solfato di potassio viene separato dai componenti insolubili della salamoia aggiungendo il composto acidificante tripolifosfato di sodio / fosfato di urea.
Questo composto aumenta la differenza tra la solubilità del solfato di potassio e la solubilità degli altri composti meno solubili, ottenendo, secondo i creatori del metodo, un solfato di potassio puro al 100%. In senso stretto non è un metodo di sintesi, ma è un nuovo metodo di estrazione.
Applicazioni
Fertilizzante

L'uso del solfato di potassio come fertilizzante è la sua principale applicazione. A questo scopo viene utilizzato il 90% della sua produzione totale. Il suo utilizzo è preferito a quello del cloruro di potassio in quelle colture sensibili alla presenza di cloruro nel terreno; per esempio il tabacco.
Il solfato di potassio ha un contenuto di potassio del 40-44%, mentre la sua concentrazione di zolfo rappresenta il 17-18% del composto. Il potassio è necessario per svolgere molte funzioni essenziali per le piante, poiché attiva reazioni enzimatiche, sintesi proteica, formazione di amido, ecc..
Inoltre, il potassio è coinvolto nella regolazione del flusso d'acqua nelle foglie. Lo zolfo è necessario per la sintesi proteica, poiché è presente negli amminoacidi che lo possiedono; è il caso della metionina, della cisteina e della cistina, e interviene anche nelle reazioni enzimatiche.
Anche il solfato di potassio viene utilizzato spruzzando sulle foglie particelle di solfato di potassio inferiori a 0,015 mm.
Uso industriale e come materia prima
Il solfato di potassio grezzo è utilizzato nella fabbricazione del vetro e nella produzione di allume e carbonato di potassio. È usato come reagente nella produzione di cosmetici. È utilizzato nella produzione di birra come agente correttivo dell'acqua.
Medicinale
È usato per correggere una grave diminuzione della concentrazione plasmatica di potassio (ipopotassiemia), causata da un uso eccessivo di diuretici che aumentano l'escrezione urinaria di potassio..
Il potassio è il principale ione intracellulare delle cellule eccitabili, comprese le cellule cardiache. Pertanto, una grave diminuzione del potassio nel plasma compromette la funzione cardiaca e deve essere corretta immediatamente..
Il solfato di potassio ha un'azione catartica, cioè favorisce l'espulsione delle feci dal colon. Per questo motivo, una miscela di solfati di potassio, magnesio e sodio viene utilizzata per ripulire il colon dalle feci prima di eseguire una colonscopia, che consente una migliore visualizzazione del colon da parte del medico..
veterinario
Il solfato di potassio è stato utilizzato per diminuire il fabbisogno di metionina nei mangimi per pollame. La presenza dello 0,1% di solfato di potassio nel mangime delle galline ovaiole è associata ad un aumento del 5% della produzione di uova.
Aromi alimentari
È un agente aromatizzante che conferisce agli alimenti un gusto amaro e salato che è desiderabile in alcuni di essi. Inoltre, si nota che il solfato di potassio è dotato dei quattro aromi fondamentali: dolcezza, amarezza, acidità e salinità..
La salinità, l'acidità e l'amaro aumentano con la concentrazione di solfato di potassio, mentre la dolcezza diminuisce.
Altri usi
Il solfato di potassio è usato come pirotecnico, in combinazione con il nitrato di potassio, per generare una fiamma viola. Usato come riduttore di flash nelle cariche del propulsore di artiglieria.
Inoltre, è utilizzato come agente che aumenta la viscosità in prodotti cosmetici come le creme per il viso..
Rischi
Il solfato di potassio è un composto a bassa tossicità con una letalità molto bassa. La DL50 per la dose orale nei topi è di 6.600 mg / kg di peso animale, il che indica che è necessaria una dose elevata per causare la morte del topo. Lo stesso valore di LD50 si verifica nei ratti.
Negli occhi, al contatto, il solfato di potassio può causare irritazione meccanica. Sulla pelle, il solfato di potassio causa pochi danni alla manipolazione industriale..
Se ingerito, il solfato di potassio può causare irritazione gastrointestinale con nausea, vomito e diarrea. Infine, l'inalazione di polvere di solfato di potassio provoca irritazione alle vie respiratorie..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Solfato di potassio. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Solfato di potassio. Database PubChem. CID = 24507. Estratto da: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5 luglio 2018). Solfato di potassio. Royal Society of Chemistry. Estratto da: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (millenovecentonovantasei). Argomenti di chimica dei fosfati. World Scientific. Estratto da: books.google.co.ve
- Libro chimico. (2017). Solfato di potassio. Estratto da: chemicalbook.com
- Shoujiang L. et al. (2019). Purificazione e rapida dissoluzione del solfato di potassio in soluzioni acquose. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Solfato di potassio. Estratto da: drugbank.ca
- The Mosaic Company. (2019). Solfato di potassio. Nutrizione delle colture. Estratto da: cropnutrition.com
- Droghe. (2018). Solfato di sodio, solfato di potassio e solfato di magnesio (orale). Estratto da: drug.com



Nessun utente ha ancora commentato questo articolo.