
Struttura, proprietà, usi, sintesi dell'idrossido di sodio (NaOH)

Il idrossido di sodio È un composto inorganico la cui formula chimica è NaOH e consiste in una base metallica molto forte o alcali. Una soluzione al 5% in acqua ha un pH vicino a 14.
È un solido bianco molto igroscopico che può anche assorbire l'anidride carbonica dall'aria per formare carbonato di sodio. Viene commercializzato in bottiglie di plastica come pillole, che non possono essere esposte troppo a lungo all'aria, né devono essere manipolate con spatole.

L'idrossido di sodio può essere sintetizzato facendo reagire l'idrossido di calcio con il carbonato di sodio. Attualmente, tuttavia, è fondamentalmente sintetizzato dall'elettrolisi della salamoia ed è un sottoprodotto della produzione di cloro gassoso.
Data l'elevata basicità del NaOH, ha numerosi usi e applicazioni, come la produzione di carta, saponi, detergenti, coloranti, ecc. Viene anche utilizzato nella pulizia della casa, nel trattamento delle acque, nella lavorazione dell'alluminio, nella produzione di medicinali, ecc.; e soprattutto è un pattern secondario per eccellenza.
L'idrossido di sodio è molto corrosivo, essendo in grado di provocare irritazioni e ustioni alla pelle e agli occhi. Inalando la sua polvere, può causare edema polmonare. Nel frattempo, la sua ingestione può causare danni così gravi al tratto digerente che può portare alla morte..
Indice articolo
- 1 Struttura
- 1.1 Anidro
- 1.2 Idrata
- 2 Proprietà fisiche e chimiche
- 2.1 Nomi
- 2.2 Massa molare
- 2.3 Aspetto
- 2.4 Punto di fusione
- 2.5 Punto di ebollizione
- 2.6 Solubilità in acqua
- 2.7 Basicità (pKb)
- 2.8 pH
- 2.9 Indice di rifrazione (nD)
- 2.10 Stabilità
- 2.11 Decomposizione
- 2.12 Punto di autoaccensione
- 2.13 Viscosità
- 2.14 Calore di vaporizzazione
- 2.15 Tensione superficiale
- 2.16 Reattività
- 3 Sintesi
- 3.1 Reazione del carbonato di sodio e dell'idrossido di calcio
- 3.2 Elettrolisi del cloruro di sodio
- 4 Usi
- 4.1 Prodotti per la pulizia
- 4.2 Prodotti farmaceutici e medicinali
- 4.3 Processi energetici
- 4.4 Trattamento dell'acqua
- 4.5 Produzione della carta
- 4.6 Produzione industriale
- 5 Rischi
- 6 Riferimenti
Struttura
Anidro

L'immagine in alto mostra gli ioni che compongono NaOH. La Na cazione+ è rappresentato dalla sfera viola, mentre l'anione idrossile (idrossido o idrossile) OH- dalla sfera rossa e bianca. Entrambi gli ioni Na+ e OH- interagiscono tra loro attraverso l'attrazione elettrostatica delle loro cariche opposte.
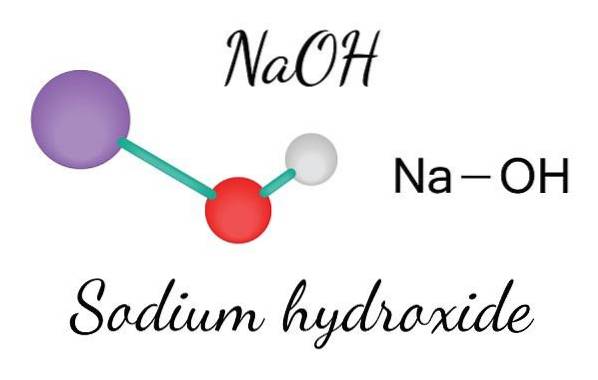
Tali interazioni sono non direzionali, quindi le attrazioni di una coppia ionica Na+Oh- può influenzare quelli degli altri a una certa distanza. Il risultato è che gli ioni di sodio+ si respingono a vicenda, nello stesso modo in cui OH-, fino a definire un cristallo di minima energia dove stabiliscono una struttura ordinata e periodica (cristallina).
Pertanto, compaiono i cristalli ortorombici di NaOH anidro (senza acqua):
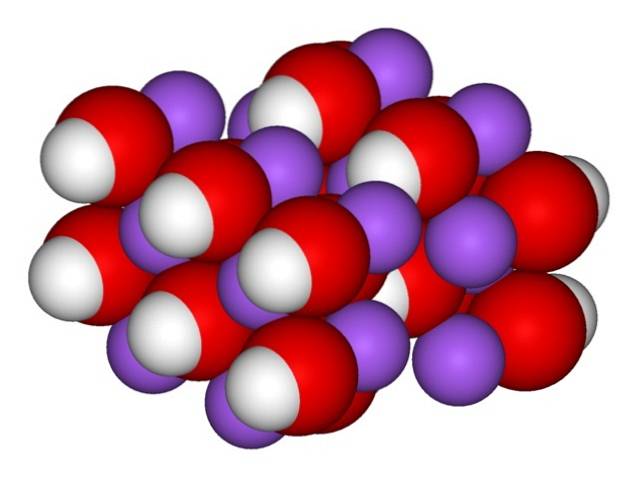
Gli ioni rimangono sufficientemente coesivi in modo che il cristallo di NaOH anidro si scioglie a 323 ºC (purché non vi sia umidità nell'ambiente).
Idrata
Sia il Na+ come OH- Sono ioni che le molecole d'acqua solvatano (idratano) facilmente. Questo favorisce la sua idratazione al di sopra dell'energia reticolare dei suoi cristalli, motivo per cui NaOH rilascia molta energia quando viene a contatto con l'acqua..
Tuttavia, i cristalli anidri possono ospitare molecole d'acqua non disciolte; cioè, l'idrossido di sodio può formare numerosi idrati, NaOH nHDueO. La molecola d'acqua può benissimo formare un legame idrogeno con l'OH- (HOH-OH-) o coordinarsi con Na+ (N / A+-OhDue).
A seconda del rapporto molare tra NaOH e H.DueOppure, monoidrati (NaOHHDueO), diidrati (NaOH 2HDueO), triemidrati (NaOH 3.5HDueO), tetraidrati (NaOH 4HDueO), eptaidrati (NaOH 7HDueO) e altro ancora.
Ciascuno di questi idrati può cristallizzare da una soluzione acquosa di NaOH con differenti percentuali di massa ea differenti temperature. Di conseguenza, NaOH mostra un complicato diagramma di solubilità in acqua..
In termini generali, i cristalli di idrati sono meno densi e hanno punti di fusione inferiori. Questo perché le molecole d'acqua “ostacolano” le interazioni tra Na+ e OH-, aggiungendo forze dipolo-dipolo al sacrificio delle attrazioni ioniche.
Proprietà fisiche e chimiche
Nomi
Nome preferito IUPAC: idrossido di sodio. Altri nomi: soda caustica, ascarite (meno comune)
Massa molare
39,9971 g / mol
Aspetto
Solido o cristalli bianchi, sierosi o opachi.
Punto di fusione
323 ºC
Punto di ebollizione
1.388 ºC
Solubilità dell'acqua
1.000 g / L alla temperatura di 25 ° C. Questo mostra quanto può dissolversi in acqua..
Le loro soluzioni acquose sono viscose, con un valore di viscosità circa ottanta volte quello dell'acqua, e all'inizio rilasciano molto calore. Se vengono a contatto con loro, rendono la pelle scivolosa, a causa della saponificazione degli acidi grassi presenti nella pelle..
Basicità (pKb)
- 0,56
pH
Una soluzione al 5% p / p in acqua ha un pH vicino a 14
Indice di rifrazione (nD)
A una lunghezza d'onda di 580,4 nm: 1.433 a 320 ºC e 1.421 a 420 ºC.
Stabilità
I contenitori che lo contengono devono essere chiusi ermeticamente per evitare la formazione di carbonato di sodio. Ciò è dovuto alla sua elevata igroscopicità, che lo porta ad assorbire l'umidità dall'ambiente circostante e il suo contenuto di CO.Due.
Decomposizione
Quando riscaldato fino alla decomposizione, emette fumo di ossido di sodio.
Punto di autoaccensione
Non è infiammabile
Viscosità
4,0 cPoise a 350 ºC
Calore di vaporizzazione
175 kJ / mol a 1.388 ºC
Tensione superficiale
74,35 dine / cm in una soluzione al 2,72% p / p in acqua a 18 ºC.
Reattività
Con acidi
Reagisce con gli acidi minerali organici e inorganici, creando l'acqua e il sale corrispondente. Nel caso dell'acido solforico la reazione è esotermica.
2 NaOH + HDueSW4 => NaDueSW4 + 2 hDueO
Con ossidi acidi
Reagisce con l'anidride solforosa, ad esempio, dando un sale solfito e acqua:
2 NaOH + SODue => NaDueSW3 + HDueO
Con i metalli
Le sue soluzioni acquose reagiscono con alcuni metalli per produrre sali di sodio complessi. Ad esempio, la sua reazione con lo zinco dà origine a uno zincato di sodio:
Zn + 2 NaOH + 2 HDueO => NaDue[Zn (OH)4] + HDue
Sintesi
L'idrossido di sodio viene sintetizzato principalmente attraverso due metodi: l'uso del carbonato di sodio, inizialmente utilizzato, e l'elettrolisi del cloruro di sodio, attualmente in maggiore uso industriale..
Reazione di carbonato di sodio e idrossido di calcio
Il carbonato di sodio reagisce con l'idrossido di calcio in un processo noto come caustizzazione:
Ca (OH)Due + N / ADueCO3 => CaCO3 + NaOH
Il carbonato di calcio precipita, lasciando idrossido di sodio nel surnatante, che viene concentrato per evaporazione.
Il carbonato di sodio proviene in precedenza dal processo Solvay:
2 NaCl + CaCO3 => NaDueCO3 + CaClDue
Elettrolisi del cloruro di sodio
L'elettrolisi del cloruro di sodio, presente nella salamoia, produce gas idrogeno, gas cloruro e idrossido di sodio in soluzione acquosa:
2 Nacl + 2 HDueO => HDue + ClDue + 2 NaOH
La camera elettrolitica è costituita da un vano in cui si trova l'anodo (+), realizzato in titanio metallico, e da un luogo in cui viene posta la salamoia. Questo compartimento è separato dal compartimento catodico (-) da una membrana porosa..
All'anodo si verifica la seguente reazione:
2 Cl- => ClDue + 2 e- (ossidazione)
Nel frattempo, questa reazione si verifica al catodo:
2 hDueO + 2 e- => HDue + Oh- (riduzione)
Sodio (Na+) si diffonde dal vano anodico a quello catodico, attraverso la membrana che li separa, formando idrossido di sodio.
Applicazioni
Prodotti per la pulizia
L'idrossido di sodio viene utilizzato per realizzare saponi e detergenti utilizzati in casa e negli affari. La combinazione di idrossido di sodio e cloro produce candeggina a base di cloro, utilizzata per lavare i vestiti bianchi.
Elimina inoltre l'accumulo di grasso nelle fognature, producendo la sua eliminazione attraverso la sua conversione in saponi attraverso il processo di saponificazione. Ciò consente l'eliminazione dell'ostruzione delle tubazioni delle abitazioni e di altri edifici.
Prodotti farmaceutici e medicinali
L'idrossido di sodio viene utilizzato per produrre antidolorifici comuni, come l'aspirina. Anche di farmaci ad azione anticoagulante che bloccano la formazione di coaguli di sangue e farmaci per ridurre l'ipercolesterolemia.
Processi energetici
L'idrossido di sodio viene utilizzato nella produzione di celle a combustibile che funzionano come batterie per produrre elettricità per una varietà di applicazioni, incluso il trasporto. Le resine epossidiche, prodotte con l'intervento di idrossido di sodio, sono utilizzate nelle turbine eoliche.
Trattamento delle acque
L'idrossido di sodio viene utilizzato per neutralizzare l'acidità dell'acqua e contribuire alla rimozione dei metalli pesanti da essa. Viene anche utilizzato per la produzione di ipoclorito di sodio, un disinfettante per l'acqua.
L'idrossido di sodio viene fatto reagire con solfato di alluminio per formare idrossido di alluminio: un agente flocculante che viene utilizzato negli impianti di trattamento delle acque per aumentare la sedimentazione delle particelle, producendo la loro chiarificazione..
Fabbricazione della carta
L'idrossido di sodio viene utilizzato con il solfuro di sodio nel trattamento del legno per ottenere la cellulosa, in forma quasi pura, che costituisce la base della carta. Viene utilizzato anche nel riciclaggio della carta, poiché aiutando a separare l'inchiostro, ne consente il riutilizzo.
Produzione industriale
L'idrossido di sodio è utilizzato nella produzione di rayon, spandex, esplosivi, resine epossidiche, vetro e ceramica. Viene utilizzato nell'industria tessile per produrre coloranti e lavorare tessuti di cotone.
Negli impianti di trattamento della canna da zucchero, l'idrossido di sodio a bassa temperatura viene utilizzato per la produzione di etanolo dalla bagassa della canna da zucchero.
Rischi
L'idrossido di sodio è un composto altamente corrosivo, quindi può provocare, a contatto con la pelle, ustioni, vesciche e anche cicatrici permanenti.
A contatto con gli occhi, può causare gravi ustioni, gonfiore, dolore, visione offuscata e, nei casi più gravi, può causare cecità permanente..
L'ingestione di idrossido di sodio può causare ustioni a labbra, lingua, gola, esofago e stomaco. I sintomi comuni includono nausea, vomito, crampi allo stomaco e diarrea..
Sebbene l'inalazione di idrossido di sodio sia rara, e possa avvenire solo per la presenza di polvere del composto nell'aria o per la formazione di una nebbia che lo contiene, produce irritazione ai polmoni..
In caso di esposizione cronica, ciò può causare edema polmonare e grave mancanza di respiro, che costituisce un'emergenza medica..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Idrossido di sodio. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Idrossido di sodio. Database PubChem. CID = 14798. Estratto da: pubchem.ncbi.nlm.nih.gov
- Elementi americani. (2019). Soluzione di idrossido di sodio. Estratto da: americanelements.com
- Fatti sulla sicurezza chimica. (2019). Idrossido di sodio. Estratto da: chemicalsafetyfacts.org
- NJ Health. (2015). Idrossido di sodio. [PDF]. Estratto da: nj.gov
- Centro canadese per la salute e la sicurezza sul lavoro. (2019). Schede informative OSH Answers: idrossido di sodio. Estratto da: ccohs.ca
- Ausetute. (s.f.). Produzione di idrossido di sodio e cloro mediante elettrolisi. Estratto da: ausetute.com.au


Nessun utente ha ancora commentato questo articolo.