
Basi caratteristiche ed esempi

Il basi sono tutti quei composti chimici che possono accettare protoni o donare elettroni. In natura o artificialmente esistono sia basi inorganiche che organiche. Pertanto, il suo comportamento può essere previsto per molte molecole ioniche o solidi..
Tuttavia, ciò che differenzia una base dal resto delle sostanze chimiche è la sua spiccata tendenza a donare elettroni rispetto, ad esempio, alle specie povere di densità elettronica. Ciò è possibile solo se si trova la coppia elettronica. Di conseguenza, le basi hanno regioni ricche di elettroni, δ-.

Quali proprietà organolettiche consentono di identificare le basi? Sono generalmente sostanze caustiche, che provocano gravi ustioni per contatto fisico. Allo stesso tempo, hanno un tocco saponoso e dissolvono facilmente i grassi. Inoltre, i suoi sapori sono amari.
Dove sono nella vita quotidiana? Una fonte commerciale e di routine di fondotinta sono i prodotti per la pulizia, dai detersivi ai saponi per le mani. Per questo l'immagine di bolle sospese nell'aria può aiutare a ricordare le basi, anche se dietro di esse sono coinvolti molti fenomeni fisico-chimici..
Molte basi mostrano proprietà totalmente diverse. Ad esempio, alcuni hanno odori sgradevoli e forti, come le ammine organiche. Altri invece, come l'ammoniaca, sono penetranti e irritanti. Possono anche essere liquidi incolori o solidi bianchi ionici..
Tuttavia, tutte le basi hanno una cosa in comune: reagiscono con gli acidi per produrre sali solubili in solventi polari, come l'acqua..
Indice articolo
- 1 Caratteristiche delle basi
- 1.1 Proprietà fisiche
- 1.2 Forza di una base
- 1.3 pH superiore a 7
- 1.4 Capacità di neutralizzare gli acidi
- 1.5 Capacità di riduzione dell'ossido
- 1.6 Rilasciare OH-
- 1.7 Hanno atomi di azoto o sostituenti che attraggono la densità elettronica
- 2 Esempi di basi
- 2.1 NaOH
- 2.2 CH3OCH3
- 2.3 Idrossidi alcalini
- 2.4 Basi organiche
- 2.5 NaHCO3
- 3 Riferimenti
Caratteristiche delle basi

A parte quanto già accennato, quali caratteristiche specifiche dovrebbero avere tutte le basi? Come possono accettare protoni o donare elettroni? La risposta sta nell'elettronegatività degli atomi della molecola o dello ione; e tra tutti l'ossigeno è quello predominante, specialmente quando si trova come ione idrossile, OH-.
Proprietà fisiche
Le basi hanno un sapore aspro e, ad eccezione dell'ammoniaca, sono inodori. La sua consistenza è scivolosa e ha la capacità di cambiare il colore della cartina di tornasole in blu, l'arancio metile in giallo e la fenolftaleina in viola..
Forza di una base
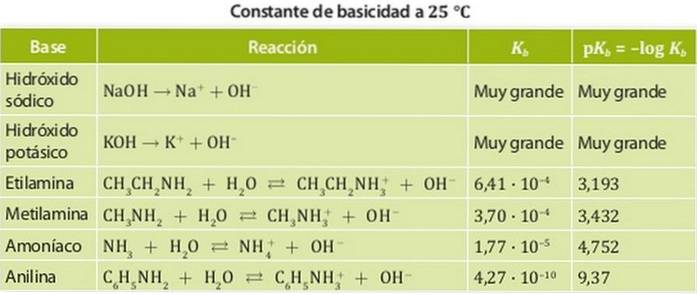
Le basi sono classificate in basi forti e basi deboli. La forza di una base è associata alla sua costante di equilibrio, quindi, nel caso delle basi, queste costanti sono chiamate costanti di basicità Kb.
Pertanto, le basi forti hanno una grande costante di basicità, quindi tendono a dissociarsi completamente. Esempi di questi acidi sono alcali come l'idrossido di sodio o di potassio, le cui costanti di basicità sono così grandi da non poter essere misurate in acqua..
D'altra parte, una base debole è quella la cui costante di dissociazione è bassa, quindi è in equilibrio chimico.
Esempi di questi sono ammoniaca e ammine le cui costanti di acidità sono dell'ordine di 10-4. La figura 1 mostra le diverse costanti di acidità per basi diverse.
pH superiore a 7
La scala del pH misura l'alcalinità o il livello di acidità di una soluzione. La scala va da zero a 14. Un pH inferiore a 7 è acido. Un pH maggiore di 7 è fondamentale. Il punto medio 7 rappresenta un pH neutro. Una soluzione neutra non è né acida né alcalina.
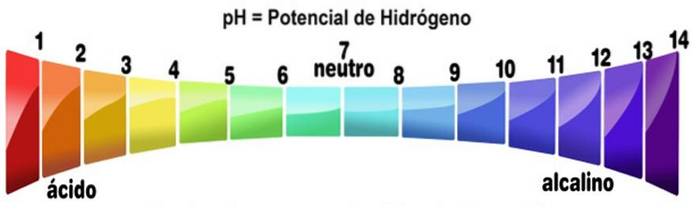
La scala del pH si ottiene in funzione della concentrazione di H.+ nella soluzione ed è inversamente proporzionale ad essa. Le basi, diminuendo la concentrazione di protoni, aumentano il pH di una soluzione.
Capacità di neutralizzare gli acidi
Arrhenius, nella sua teoria, propone che gli acidi, essendo in grado di generare protoni, reagiscano con l'idrossile delle basi per formare sale e acqua nel modo seguente:
HCl + NaOH → NaCl + HDueO.
Questa reazione è chiamata neutralizzazione ed è alla base della tecnica analitica chiamata titolazione..
Capacità di riduzione dell'ossido
Data la loro capacità di produrre specie cariche, le basi vengono utilizzate come mezzo per il trasferimento di elettroni nelle reazioni redox..
Le basi hanno anche la tendenza a ossidarsi poiché hanno la capacità di donare elettroni liberi..
Le basi contengono ioni OH. Possono agire per donare elettroni. L'alluminio è un metallo che reagisce con le basi.
2Al + 2NaOH + 6HDueO → 2 NaAl (OH)4+3HDue
Non corrodono molti metalli, perché i metalli tendono a perdere piuttosto che accettare elettroni, ma le basi sono altamente corrosive per le sostanze organiche come quelle che compongono la membrana cellulare..
Queste reazioni sono generalmente esotermiche, che provocano gravi ustioni a contatto con la pelle, quindi questo tipo di sostanza deve essere maneggiata con cura. La Figura 3 è l'indicatore di sicurezza quando una sostanza è corrosiva.

Rilasciano OH-
Per cominciare, l'OH- Può essere presente in molti composti, principalmente negli idrossidi metallici, poiché in compagnia dei metalli tende a "strappare" protoni per formare acqua. Quindi, una base può essere qualsiasi sostanza che rilascia questo ione in soluzione attraverso un equilibrio di solubilità:
M (OH)Due <=> MDue+ + 2OH-
Se l'idrossido è molto solubile l'equilibrio è totalmente spostato a destra dell'equazione chimica e si parla di una base forte. M (OH)Due , invece, è una base debole, in quanto non rilascia completamente i suoi ioni OH- in acqua. Una volta l'OH- prodotto può neutralizzare qualsiasi acido che si trova intorno ad esso:
Oh- + HA => A- + HDueO
E così l'OH- deprotona l'acido HA per trasformarlo in acqua. Perché? Perché l'atomo di ossigeno è molto elettronegativo e ha anche una densità elettronica in eccesso a causa della carica negativa.
O ha tre coppie di elettroni liberi e può donarne uno qualsiasi all'atomo H parzialmente caricato positivamente, δ +. Allo stesso modo, la grande stabilità energetica della molecola d'acqua favorisce la reazione. In altre parole: H.DueOppure è molto più stabile dell'HA, e quando ciò è vero si verificherà la reazione di neutralizzazione.
Basi coniugate
E che dire di OH- già-? Entrambe sono basi, con la differenza che A- è il base coniugata acido HA. Inoltre, A- è una base molto più debole di OH-. Da qui si giunge alla seguente conclusione: una base reagisce per generarne una più debole.
Base Forte + Acido Forte => Base Debole + Acido Debole
Come si può vedere dall'equazione chimica generale, lo stesso vale per gli acidi.
Base coniugata A- può deprotonare una molecola in una reazione nota come idrolisi:
PER- + HDueO <=> HA + OH-
Tuttavia, a differenza di OH-, stabilisce un equilibrio quando neutralizzato con acqua. Anche in questo caso è perché A- è una base molto più debole, ma sufficiente a produrre un cambiamento nel pH della soluzione.
Pertanto, tutti quei sali che contengono A- sono conosciuti come sali basici. Un esempio di questi è il carbonato di sodio, NaDueCO3, che dopo la dissoluzione basica la soluzione attraverso la reazione di idrolisi:
CO3Due- + HDueO <=> HCO3- + Oh-
Hanno atomi di azoto o sostituenti che attraggono la densità elettronica
Una base non è solo solidi ionici con anioni OH- nel loro reticolo cristallino possono anche avere altri atomi elettronegativi come l'azoto. Questi tipi di basi appartengono alla chimica organica e tra le più comuni ci sono le ammine.
Qual è il gruppo amminico? R-NHDue. Sull'atomo di azoto c'è una coppia elettronica non condivisa, che può, così come l'OH-, deprotonare una molecola d'acqua:
R-NHDue + HDueO <=> RNH3+ + Oh-
L'equilibrio è fortemente spostato a sinistra, poiché l'ammina, sebbene di base, è molto più debole dell'OH-. Si noti che la reazione è simile a quella data per la molecola di ammoniaca:
NH3 + HDueO <=> NH4+ + Oh-
Solo le ammine non possono formare correttamente il catione NH4+; sebbene RNH3+ è il catione di ammonio con una monosostituzione.
E può reagire con altri composti? Sì, con chiunque abbia idrogeno sufficientemente acido, anche se la reazione non avviene completamente. Cioè, solo un'ammina molto forte reagisce senza stabilire l'equilibrio. Allo stesso modo, le ammine possono donare la loro coppia di elettroni a specie diverse da H (come i radicali alchilici: -CH3).
Basi con anelli aromatici
Le ammine possono anche avere anelli aromatici. Se la sua coppia di elettroni può essere "persa" all'interno dell'anello, perché l'anello attrae la densità elettronica, la sua basicità diminuirà. Perché? Poiché più tale coppia è localizzata all'interno della struttura, più velocemente reagirà con le specie povere di elettroni.
Ad esempio, NH3 è fondamentale perché la sua coppia di elettroni non ha nessun posto dove andare. Lo stesso accade con le ammine, siano esse primarie (RNHDue), secondario (RDueNH) o terziario (R3N). Questi sono più basici dell'ammoniaca perché, oltre a quanto appena spiegato, l'azoto attrae densità elettroniche più elevate dei sostituenti R, aumentando così δ-.
Ma quando c'è un anello aromatico, detta coppia può entrare in risonanza al suo interno, rendendo impossibile partecipare alla formazione di legami con H o altre specie. Pertanto, le ammine aromatiche tendono ad essere meno basiche, a meno che la coppia di elettroni non rimanga fissa sull'azoto (come con la molecola di piridina).
Esempi di basi
NaOH
L'idrossido di sodio è una delle basi più utilizzate al mondo. Le sue applicazioni sono innumerevoli, ma tra queste possiamo citare il suo utilizzo per saponificare alcuni grassi e quindi fare sali basici degli acidi grassi (saponi).
CH3OCH3
Strutturalmente, può sembrare che l'acetone non accetti protoni (o doni elettroni), eppure lo fa, anche se è una base molto debole. Questo perché l'atomo di O elettronegativo attrae le nubi di elettroni dei gruppi CH.3, accentuando la presenza delle sue due coppie di elettroni (: O :).
Idrossidi alcalini
Oltre a NaOH, anche gli idrossidi di metalli alcalini sono basi forti (con la leggera eccezione di LiOH). Quindi, tra le altre basi ci sono le seguenti:
-KOH: idrossido di potassio o potassa caustica, è una delle basi più utilizzate in laboratorio o nell'industria, per il suo grande potere sgrassante.
-RbOH: idrossido di rubidio.
-CsOH: idrossido di cesio.
-FrOH: idrossido di francio, la cui basicità si presume teoricamente essere una delle più forti mai conosciute.
Basi organiche
-CH3CHDueNHDue: etilammina.
-LiNHDue: litio ammide. Insieme all'ammide di sodio, NaNHDue, sono una delle basi organiche più forti. In loro l'anione ammide, NHDue- è la base che deprotona l'acqua o reagisce con gli acidi.
-CH3ONa: metossido di sodio. Qui la base è l'anione CH3O-, che può reagire con gli acidi per dare metanolo, CH3Oh.
-Reagenti di Grignard: hanno un atomo di metallo e un alogeno, RMX. In questo caso, il radicale R è la base, ma non proprio perché toglie un idrogeno acido, ma perché rinuncia alla sua coppia di elettroni che condivide con l'atomo di metallo. Ad esempio: etilmagnesio bromuro, CH3CHDueMgBr. Sono molto utili nella sintesi organica.
NaHCO3
Il bicarbonato di sodio viene utilizzato per neutralizzare l'acidità in condizioni miti, ad esempio all'interno della bocca come additivo nei dentifrici.
Riferimenti
- Merck KGaA. (2018). Basi organiche. Tratto da: sigmaaldrich.com
- Wikipedia. (2018). Basi (chimica). Tratto da: es.wikipedia.org
- Chimica 1010. Acidi e basi: cosa sono e dove si trovano. [PDF]. Tratto da: cactus.dixie.edu
- Acidi, basi e scala del pH. Tratto da: 2.nau.edu
- Il gruppo Bodner. Definizioni di acidi e basi e ruolo dell'acqua. Tratto da: chemed.chem.purdue.edu
- Chemistry LibreTexts. Basi: proprietà ed esempi. Tratto da: chem.libretexts.org
- Shiver & Atkins. (2008). Chimica inorganica. Sopra Acidi e basi. (quarta edizione). Mc Graw Hill.
- Helmenstine, Todd. (4 agosto 2018). Nomi di 10 basi. Estratto da: thoughtco.com



Nessun utente ha ancora commentato questo articolo.