
Proprietà fisiche e chimiche e usi dell'acido bromous (HBrO2)

Il acido bromo È un composto inorganico della formula HBrO2. Detto acido è uno degli acidi bromo ossiacido dove si trova in uno stato di ossidazione 3+. I sali di questo composto sono noti come bromiti. È un composto instabile che non è stato possibile isolare in laboratorio.
Questa instabilità, analoga all'acido iodico, è dovuta a una reazione di dismutazione (o sproporzione) per formare acido ipobromoso e acido bromico come segue: 2HBrODue → HBrO + HBrO3.
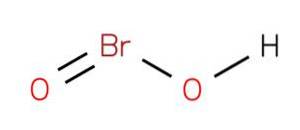
L'acido bromo può agire come intermedio in diverse reazioni nell'ossidazione degli ipobromiti (Ropp, 2013). Può essere ottenuto con mezzi chimici o elettrochimici in cui l'ipobromite viene ossidato allo ione bromito come:
HBrO + HClO → HBrODue + HCl
HBrO + HDueO + 2e- → HBrODue + HDue
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Usi
- 2.1 Composti alcalino terrosi
- 2.2 Agente riducente
- 2.3 Reazione di Belousov-Zhabotinski
- 3 Riferimenti
Proprietà fisiche e chimiche
Come accennato in precedenza, l'acido bromo è un composto instabile che non è stato isolato, quindi le sue proprietà fisiche e chimiche si ottengono, con alcune eccezioni, teoricamente attraverso calcoli computazionali (National Center for Biotechnology Information, 2017).
Il composto ha un peso molecolare di 112,91 g / mol, un punto di fusione di 207,30 gradi centigradi e un punto di ebollizione di 522,29 gradi centigradi. La sua solubilità in acqua è stimata in 1 x 106 mg / L (Royal Society of Chemistry, 2015).
Non vi è alcun rischio registrato nella manipolazione di questo composto, tuttavia, è stato riscontrato che è un acido debole..
La cinetica della reazione di sproporzione del bromo (III), 2Br (III) → Br (1) + Br (V), è stata studiata in tampone fosfato, nell'intervallo di pH di 5,9-8,0, monitorando l'assorbanza ottica a 294 nm utilizzando flusso.
Le dipendenze di [H+] e [Br (III)] erano di ordine 1 e 2 rispettivamente, dove non è stata trovata alcuna dipendenza da [Br-]. La reazione è stata anche studiata in tampone acetato, nell'intervallo di pH 3,9 - 5,6.
All'interno dell'errore sperimentale, non è stata trovata alcuna prova di una reazione diretta tra due ioni BrO2. Questo studio fornisce costanti di velocità 39,1 ± 2,6 M.-1 per la reazione:
HBrODue + FraDue→ HOBr + Br03-
Costanti di velocità 800 ± 100 M.-1 per la reazione:
2HBr0Due → HOBr + Br03- + H+
E un quoziente di equilibrio di 3,7 ± 0,9 X 10-4 per la reazione:
HBr02 ⇌ H + + BrODue-
Ottenere un pKa sperimentale di 3,43 con una forza ionica di 0,06 M e 25,0 ° C (R. B. Faria, 1994).
Applicazioni
Composti alcalino terrosi
L'acido bromico o il bromito di sodio viene utilizzato per produrre il bromito di berillio in base alla reazione:
Essere (oh)Due + HBrODue → Be (OH) BrODue + HDueO
I bromiti sono di colore giallo allo stato solido o in soluzioni acquose. Questo composto è utilizzato industrialmente come agente disincrostante ossidativo dell'amido nella raffinazione dei tessuti (Egon Wiberg, 2001).
Agente riducente
L'acido bromico o i bromiti possono essere utilizzati per ridurre lo ione permanganato in manganato come segue:
2MnO4- + FraDue- + 2OH-→ BrO3- + 2MnO4Due- + HDueO
Cosa è conveniente per la preparazione di soluzioni di manganese (IV).
Reazione di Belousov-Zhabotinski
L'acido bromo agisce come un importante intermedio nella reazione di Belousov-Zhabotinski (Stanley, 2000), che è una dimostrazione visivamente sorprendente..
In questa reazione, tre soluzioni vengono miscelate per formare un colore verde, che diventa blu, viola e rosso, quindi torna al verde e si ripete.
Le tre soluzioni mescolate sono le seguenti: una soluzione KBrO3 0,23 M, una soluzione di acido malonico 0,31 M con 0,059 M KBr e una soluzione di nitrato di ammonio 0,019 M cerio (IV) e HDueSW4 2.7M.
Durante la presentazione, una piccola quantità dell'indicatore di ferroina viene introdotta nella soluzione. Gli ioni manganese possono essere usati al posto del cerio. La reazione B-Z complessiva è l'ossidazione catalizzata da cerio dell'acido malonico da parte di ioni bromato in acido solforico diluito come presentato nella seguente equazione:
3CHDue (CODueH)Due + 4 BrO3- → 4 Br- + 9 CODue + 6 hDueO (1)
Il meccanismo di questa reazione coinvolge due processi. Il processo A coinvolge ioni e trasferimenti di due elettroni, mentre il processo B coinvolge radicali e trasferimenti di un elettrone..
La concentrazione di ioni bromuro determina quale processo è dominante. Il processo A è dominante quando la concentrazione di ioni bromuro è alta, mentre il processo B è dominante quando la concentrazione di ioni bromuro è bassa..
Il processo A è la riduzione degli ioni bromato da parte degli ioni bromuro in due trasferimenti di elettroni. Può essere rappresentato da questa reazione netta:
Fra3- + 5Br- + 6H+ → 3BrDue + 3HDueOppure (2)
Ciò si verifica quando si mescolano le soluzioni A e B. Questo processo avviene tramite i tre passaggi seguenti:
Fra3- + Br- +2 h+ → HBrODue + HOBr (3)
HBrODue + Br- + H+ → 2 PIANI (4)
HOBr + Br- +H+ → BrDue + HDueOppure (5)
Il bromo creato dalla reazione 5 reagisce con l'acido malonico mentre enolizza lentamente, come rappresentato dalla seguente equazione:
BrDue + CHDue (CODueH)Due → BrCH (CODueH)Due + Br- + H (6)
Queste reazioni lavorano per ridurre la concentrazione di ioni bromuro nella soluzione. Ciò consente al processo B di diventare dominante. La reazione complessiva del processo B è rappresentata dalla seguente equazione:
2BrO3- + 12H+ + 10 Ce3+ → BrDue + 10Ce4+6HDueOPPURE (7)
E consiste nei seguenti passaggi:
Fra3 - + HBrODue + H+ → 2BrODue • + HDueOPPURE (8)
FraDue • + Ce3+ + H+ → HBrODue + CE4+ (9)
2 HBrODue → HOBr + BrO3 - + H+ (10)
2 HOBr → HBrODue + Br- + H+ (undici)
HOBr + Br- + H+ → BrDue + HDueO (12)
Gli elementi chiave di questa sequenza includono il risultato netto dell'equazione 8 più due volte l'equazione 9, mostrato di seguito:
2Ce3+ + Fra3 - + HBrODue + 3H+ → 2Ce4+ + HDueO + 2HBrODue (13)
Questa sequenza produce acido bromo in modo autocatalitico. L'autocatalisi è una caratteristica essenziale di questa reazione, ma non continua fino a quando i reagenti non sono esauriti, perché c'è una distruzione del secondo ordine di HBrO2, come si vede nella reazione 10.
Le reazioni 11 e 12 rappresentano la sproporzione dell'acido iperbromoso rispetto all'acido bromo e al Br2. Gli ioni cerio (IV) e il bromo ossidano l'acido malonico per formare ioni bromuro. Ciò provoca un aumento della concentrazione di ioni bromuro, che riattiva il processo A.
I colori in questa reazione sono formati principalmente dall'ossidazione e dalla riduzione dei complessi ferro-cerio..
La ferroina fornisce due dei colori visti in questa reazione: all'aumentare di [Ce (IV)], ossida il ferro nella ferroina dal ferro rosso (II) al ferro blu (III). Il cerio (III) è incolore e il cerio (IV) è giallo. La combinazione di cerio (IV) e ferro (III) rende il colore verde.
Nelle giuste condizioni, questo ciclo si ripeterà più volte. La pulizia della vetreria è un problema perché le oscillazioni sono interrotte dalla contaminazione da ioni cloruro (Horst Dieter Foersterling, 1993).
Riferimenti
- acido bromo. (2007, 28 ottobre). Estratto da ChEBI: ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Chimica inorganica. london-san diego: stampa accademica.
- Horst Dieter Foersterling, M. V. (1993). Acido bromo / cerio (4+): reazione e disproporzione di HBrO2 misurata in soluzione di acido solforico a differenti acidità. Phys. Chem 97 (30), 7932-7938.
- acido iodio. (2013-2016). Estratto da molbase.com.
- Centro nazionale per le informazioni sulla biotecnologia. (2017, 4 marzo). Database composto di PubChem; CID = 165616.
- B. Faria, I. R. (1994). Cinetica della sproporzione e pKa dell'acido bromo. J. Phys. Chem. 98 (4), 1363-1367.
- Ropp, R. C. (2013). Enciclopedia dei composti alcalini terrosi. Oxford: Elvesier.
- Royal Society of Chemistry. (2015). Acido bromo. Estratto da chemspider.com.
- Stanley, A. A. (2000, 4 dicembre). Sintesi della dimostrazione di chimica inorganica avanzata reazione oscillante.


Nessun utente ha ancora commentato questo articolo.