
Proprietà, rischi e usi dell'acido bromico (HBrO3)
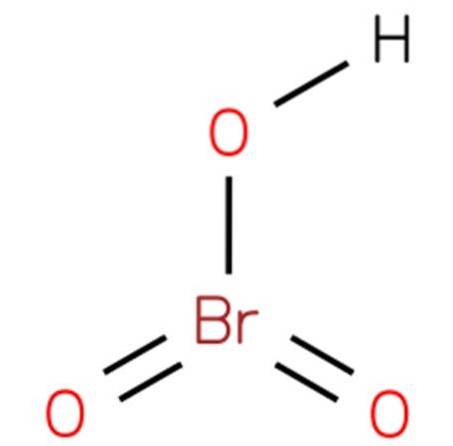
Il acido bromico, Conosciuto anche come bromato di idrogeno o acido bromico (V), è un composto chimico con la formula HBrO3. È un bromo ossacido con una struttura analoga all'acido clorico (EMBL-EBI, 2014). Il composto è un acido molto forte. La sua struttura è presentata nella figura 1 (EMBL-EBI, 2008).
Per preparare l'acido bromico, un bromato solubile viene solitamente sciolto in acqua e viene aggiunto un sale di bario solubile. Precipita bromato di bario a bassa solubilità.
Il bromato di bario può quindi essere sciolto in acqua e acidificato con acido solforico per far precipitare il solfato di bario fondamentalmente insolubile e lasciare l'acido bromico dietro (vedi immagine sopra):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Il composto può anche essere prodotto per decomposizione del bromo pentacloruro in soluzione alcalina secondo la reazione:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
L'acido bromico è un forte agente ossidante. Lo ione bromato può essere ulteriormente ossidato con fluoro elementare o difluoruro di xeno in presenza di base, ossidazione accompagnata da piccole esplosioni e il tubo di teflon preso fuoco (My Favorite Chemicals, S.F.).
Indice articolo
- 1 Proprietà fisiche e chimiche dell'acido bromico
- 2 Reattività e pericoli
- 2.1 In caso di contatto con gli occhi
- 2.2 In caso di contatto con la pelle
- 2.3 In caso di inalazione
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche dell'acido bromico
L'acido bromico esiste solo in una soluzione incolore (fino al 50% p / v) che diventa giallastra a contatto con l'aria (National Center for Biotechnology Information., 2017). Il suo aspetto è mostrato in figura 2.

Il composto ha un peso molecolare di 128,91 g / mol e si decompone a 100 ° C e ha un pKa di -2. Essendo un composto instabile, le sue proprietà fisico-chimiche sono state ottenute tramite calcoli computazionali..
Ha un punto di fusione di 206,04 ° C, un punto di ebollizione di 517,26 ° C e una solubilità in acqua di 1 x 106 mg / la 25 ° C (Royal Society of Chemistry, 2015).
Il composto è un forte agente ossidante. Quando miscelato con etanolo o etere, si decompone per formare acido acetico in una reazione esotermica. È essenziale per l'elaborazione di sali di bromato (BrO3-) che vengono preparati facendo reagire carbonati o ossidi metallici con acido bromico (Watts, 1870).
Reattività e rischi
L'acido bromico è un composto instabile che si decompone in bromo elementare. Essendo un acido forte, è estremamente pericoloso in caso di contatto con la pelle (corrosivo e irritante), a contatto con gli occhi (irritante) e in caso di ingestione. Anche molto pericoloso, in caso di inalazione.
Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte. L'esposizione prolungata può provocare ustioni e ulcerazioni della pelle. La sovraesposizione inalatoria può causare irritazione respiratoria..
L'infiammazione degli occhi è caratterizzata da arrossamento, lacrimazione e prurito. L'infiammazione della pelle è caratterizzata da prurito, desquamazione, arrossamento e occasionalmente vesciche.
La sostanza è tossica per i reni, i polmoni e le mucose. L'esposizione ripetuta o prolungata alla sostanza può causare danni a questi organi..
In caso di contatto con gli occhi
Verificare se si indossano lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, tenendo le palpebre aperte. È possibile utilizzare acqua fredda. Unguento per gli occhi non deve essere utilizzato.
In caso di contatto con la pelle
Se la sostanza chimica viene a contatto con gli indumenti, rimuoverla il più rapidamente possibile, proteggendo le mani e il corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula sulla pelle esposta della vittima, come le mani, la pelle contaminata viene lavata delicatamente e accuratamente con acqua corrente e sapone non abrasivo. È possibile utilizzare acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare gli indumenti contaminati prima di riutilizzarli.
Se il contatto con la pelle è grave, deve essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
In caso di inalazione
Si consiglia di far riposare la vittima in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il prima possibile. Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta. Se la vittima ha difficoltà a respirare, deve essere somministrato ossigeno.
Se la vittima non respira, viene eseguita la rianimazione bocca a bocca. Tenere sempre presente che può essere pericoloso per la persona che fornisce assistenza eseguire la rianimazione bocca a bocca quando il materiale inalato è tossico, infettivo o corrosivo..
In caso di ingestione, non provocare il vomito. Allenta indumenti stretti come colletti di camicie, cinture o cravatte. Se la vittima non respira, eseguire la rianimazione bocca a bocca.
In tutti i casi, consultare immediatamente un medico..
Applicazioni
L'acido bromico è usato come potente agente ossidante nelle reazioni di laboratorio. Viene utilizzato per produrre composti chimici come iodati, acido clorico, acido tetraionico tra gli altri..
Viene anche utilizzato per la produzione di bromati come ferro, piombo, manganese e bromato di mercurio, tra gli altri..
L'acido bromico agisce come un importante intermedio nella reazione di Bélousov-Zhabotinsky (Morris, 2010). Questa reazione è un esempio di orologi chimici e illustra una reazione di non equilibrio termodinamico.
La reazione di oscillazione è catalizzata dal cerio ed è intrinsecamente connessa alla chimica del bromo ossoacido HBrOx. Il crescente interesse per i sistemi chimici non lineari ha fornito forti incentivi a studiare la chimica del bromo..
Nella reazione di Belousov-Zhabotinsky, i composti di bromo coinvolti sono l'acido ipobromoso HOBr, l'acido bromo HOBrO e l'acido bromico HBrO3 (3) (Rainer Glaser, 2013).
Questi tipi di reazioni sono importanti per la chimica teorica. Mostrano che le reazioni chimiche non devono essere dominate dal comportamento termodinamico di equilibrio.
Riferimenti
- Acido bromico. (S.F.). Recuperato da chemyq.com.
- EMBL-EBI. (2008, 16 maggio). acido bromico. Recupero da ebi.ac.uk.
- EMBL-EBI. (2014, 28 luglio). acido clorico. Recupero da ebi.ac.uk.
- Morris, S. (2010, 23 gennaio). Reazione di Belousov Zhabotinsky 8 volte la velocità normale. Recuperato da youtubecom.
- I miei prodotti chimici preferiti. (S.F.). Recupero da bromicacid.com.
- Centro nazionale per le informazioni sulla biotecnologia. (2017, 11 marzo). Database composto di PubChem; CID = 24445 ,. Estratto da PubChem.
- Rainer Glaser, M. D. (2013). Perché l'acidità dell'acido bromico è davvero importante per i modelli cinetici delle reazioni chimiche oscillanti di Belousov-Zhabotinsky. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Acido bromico. Recupero da chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volume 1. London: longmans, green and co.


Nessun utente ha ancora commentato questo articolo.