
Struttura, proprietà, usi, produzione del bisolfito di sodio (NaHSO3)

Il bisolfito di sodio è un solido inorganico formato da uno ione sodio Na+ e uno ione bisolfito HSO3-. La sua formula chimica è NaHSO3. È un solido cristallino bianco e per le sue proprietà antiossidanti trova largo impiego come conservante alimentare (ad esempio in alcune marmellate).
Il NaHSO3 è un composto chimico riducente, che è l'opposto dell'ossidante, e per questo motivo agisce come antiossidante in molte delle sue applicazioni, come nei prodotti commestibili, poiché ne previene il deterioramento.

Tuttavia, questo uso è stato messo in dubbio poiché sono stati segnalati casi di asma in persone dopo aver mangiato cibi che contengono bisolfito di sodio. Si dice persino che distrugga la vitamina B1 in questi.
Le organizzazioni sanitarie internazionali ne hanno limitato l'uso a micro-quantità negli alimenti.
Tuttavia, il bisolfito di sodio ha molti altri usi, come per ottenere lo iodio, come anti-infettivo, per sbiancare i tessuti, per la digestione del legno durante la preparazione della pasta di carta, come disinfettante per botti di birra e vino., Ecc..
Indice articolo
- 1 Struttura chimica
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3,6 pH
- 3.7 Proprietà chimiche
- 3.8 Rischi
- 4 Ottenimento
- 5 Usi
- 5.1 Nell'industria della pasta di legno e della carta
- 5.2 Nell'industria alimentare
- 5.3 Polemica sul suo utilizzo negli alimenti
- 5.4 Nelle applicazioni agricole
- 5.5 Per ottenere iodio
- 5.6 Nell'industria del mobile e del legno
- 5.7 In varie applicazioni
- 6 Riferimenti
Struttura chimica
Il bisolfito di sodio è costituito da un catione di sodio Na+ e un anione bisolfito HSO3-.
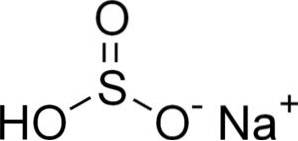
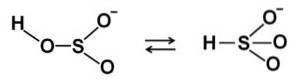
In soluzioni acquose il bisolfito forma 4 specie. In soluzione diluita c'è un equilibrio tra le strutture mostrate di seguito:
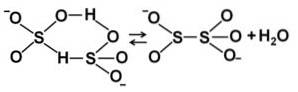
Quando la concentrazione aumenta, due molecole di bisolfito interagiscono tra loro, formando lo ione pirosolfito SDueO5Due-:
Nomenclatura
-Bisolfito di sodio
-Sodio idrogeno solforato
-Idrosolfito di sodio.
Proprietà
Stato fisico
Solido bianco cristallino.
Peso molecolare
104,06 g / mol
Punto di fusione
Si decompone.
Densità
1,48 g / cm3 a 20 ºC.
Solubilità
Solubile in acqua: 29 g / 100 g di acqua.
pH
Le sue soluzioni sono acide, con un pH compreso tra 2,5 e 5,5.
Proprietà chimiche
In soluzione acquosa bisolfito di sodio NaHSO3 si separa nei suoi ioni: il catione sodio Na+ e l'anione bisolfito HSO3-.
Se il bisolfito di sodio viene esposto all'aria, perde un po 'di SODue e si ossida lentamente a Na solfatoDueSW4.
Se riscaldato fino alla decomposizione, emette fumi di ossidi di zolfo e monossido di sodio..
È un agente riducente, che è l'opposto dell'ossidante. E per questo può comportarsi come un antiossidante.
Ha un leggero odore di zolfo. Non è infiammabile.
Rischi
Bisolfito di sodio NaHSO3 è un forte irritante per la pelle e i tessuti. La polvere irrita gli occhi, il naso e la gola. Se ingerito, irrita lo stomaco. Grandi dosi possono causare coliche violente, diarrea, depressione e morte..
Non è combustibile ma se riscaldato produce gas irritanti e tossici.
Ottenere
Si prepara saturando una soluzione di carbonato di sodio NaDueCO3 con anidride solforosa SODue e cristallizza in soluzione.
Applicazioni
Nell'industria della cellulosa e della carta
Il NaHSO3 Viene utilizzato nella digestione del legno, in modo che possa successivamente diventare carta. Serve anche come candeggina per la polpa.
Viene anche usato per rimuovere il cloro quando la pasta di carta è stata sbiancata con esso..
Nell'industria alimentare
Il bisolfito di sodio, per la sua proprietà riducente, agisce come antiossidante.
È usato come conservante in un gran numero di cibi e bevande, inclusi vino e birra, per prevenire il deterioramento e migliorare il sapore.
È usato per sbiancare gli alimenti, come alcuni amidi commestibili.
Riduce o previene il deterioramento degli alimenti, consente di condizionare l'impasto utilizzato nei prodotti da forno e serve ad ammorbidire i chicchi di mais durante la macinazione a umido, tra gli altri usi.
Oltre a controllare la fermentazione del vino e della birra, agisce come antisettico nella sua preparazione poiché funge da sterilizzatore e fungicida in botti e tini..

Nella frutta secca si trova in concentrazioni superiori a 100 ppm (ppm significa "parti per milione"), in molti altri alimenti si trova in concentrazioni comprese tra 10 e 100 ppm, come patate congelate e secche, sottaceti, salse e marmellate.

Polemica sul suo utilizzo negli alimenti
C'è stata una certa preoccupazione per gli effetti tossici sia immediati che a lungo termine del bisolfito di sodio negli alimenti. Ci sono opinioni divergenti.
Sono state segnalate reazioni avverse in pazienti con asma, che è una malattia respiratoria, dopo l'ingestione di cibo con NaHSO3. Altre fonti indicano che lo ione bisolfito può distruggere la vitamina B1 o la tiamina.

Tuttavia, alcuni ricercatori nel 1985 hanno scoperto che il bisolfito di sodio serve a proteggere dalle radiazioni e dagli agenti chimici e inibisce o previene la trasformazione delle cellule verso il cancro. Le dosi basse sono le migliori.
Questo effetto protettivo è stato spiegato in base alle sue proprietà riducenti o antiossidanti e che in questo modo potrebbe attaccare i radicali liberi.
D'altra parte, l'Organizzazione mondiale della sanità, o OMS (per il suo acronimo in inglese Organizzazione mondiale della Sanità), raccomanda come livello accettabile di assunzione giornaliera circa 0,7 mg / Kg di peso della persona.
Ciò significa che si consiglia di non superare tale importo..
La Food and Drug Administration degli Stati Uniti, o USFDA. Food and Drug Administration degli Stati Uniti), classificato bisolfito di sodio come "generalmente riconosciuto come sicuro".
Nelle applicazioni agricole
NaHSO utilizzato a basse concentrazioni3 funge da regolatore della crescita delle piante, per migliorare la fotosintesi e promuovere la resa delle colture.
È stato testato a questo scopo in vari tipi di piante, come fragole e piante da tè..

È l'ingrediente attivo di molti pesticidi e biocidi.
Negli ambienti acquatici può anche accelerare la trasformazione di alcuni erbicidi in prodotti meno tossici eliminando il cloro..
Nell'ottenere iodio
Il NaHSO3 è il composto riducente utilizzato per liberare lo iodio dallo iodato di sodio NaIO3. Questo è uno dei modi per ottenere lo iodio da fonti come il nitro dal Cile o alcune acque saline.
Dopo aver cristallizzato il nitrato di sodio dalla soluzione grezza di nitrato cileno, rimane una soluzione NaIO3 che viene trattato con bisolfito di sodio NaHSO3, generazione di iodio libero.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + N / ADueSW4 + ioDue
Nell'industria del mobile e del legno
Il NaHSO3 È stato testato per modificare le proteine della soia e migliorare le loro proprietà di adesione con il legno al fine di incollare pezzi di legno insieme per preparare ad esempio truciolato, cartone o cartapesta, compensato, ecc. Tutto questo per mobili o tavole, tra le varie applicazioni.

Questo viene fatto per sostituire i tradizionali adesivi a base di formaldeide perché sia nel loro processo di produzione che durante il loro utilizzo tendono a rilasciare formaldeide nell'atmosfera, che è un composto tossico..
Il bisolfito di sodio migliora il contenuto di solidi dell'adesivo proteico di soia, e ne diminuisce la viscosità, migliorandone la fluidità in modo che penetri meglio nei pori del legno, aumentandone la coesione con esso e tra i pezzi..
L'adesivo per proteine di soia modificato NaHSO3 ha una buona resistenza all'acqua e un'ottima stabilità allo stoccaggio grazie all'azione antiossidante del bisolfito di sodio.
Ciò conferma che gli adesivi proteici di soia modificati con NaHSO3 sono paragonabili agli adesivi a base di formaldeide e possono essere utilizzati nell'industria del mobile e del legno, essendo meno inquinanti.
In varie applicazioni
Ha molteplici usi, generalmente basati sulle sue proprietà riducenti (che è l'opposto dell'ossidante). Ecco alcune applicazioni.
-Nella fotografia.
-Nella concia delle pelli, per rimuovere i peli dalle pelli.
-Usi terapeutici: antinfettivo. È usato come antiossidante in alcuni colliri.
-Nell'estrazione di gas naturale mediante fratturazione idraulica.
-Nella colorazione delle fibre viene utilizzato per la preparazione di vasche da bagno calde o fredde, per solubilizzare determinati coloranti o coloranti.
-Come riduttore in bucato o candeggio, per sbiancare lana, seta e fibre vegetali.
-Nei laboratori di chimica per rimuovere le macchie di permanganato dalla pelle e dai vestiti. Nei laboratori di biochimica come conservante per liquidi o soluzioni che possono deteriorarsi nel tempo. Come reagente chimico.
-Per la coagulazione del lattice di gomma.
-Nell'industria cosmetica come antiossidante.
-Disinfettante e candeggina.
-Nel trattamento delle acque reflue per eliminare il cloro utilizzato nella fase finale di disinfezione e per scaricare nell'ambiente l'acqua già trattata.

Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Bisolfito di sodio. Recupero da pubchem.ncbi.nlm.nih.gov.
- Qi, G. et al. (2013). Adesione e proprietà fisico-chimiche della proteina di soia modificata dal bisolfito di sodio. J Am Oil Chem Soc (2013) 90: 1917-1926. Recupero da aocs.onlinelibrary.wiley.com.
- Borek, C. et al. (1985). Il bisolfito di sodio protegge dalla trasformazione radiogena e indotta chimicamente nell'embrione di criceto e nelle cellule C3H / 10T-1/2 di topo. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Recupero da journals.sagepub.com.
- Friedler, E. et al. (2015). Un approccio di monitoraggio attivo continuo per identificare le connessioni incrociate tra acqua potabile e sistemi di distribuzione degli effluenti. Environ Monit Assess (2015) 187: 131. Recuperato da link.springer.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Programma Sunnyvale Cleanwater. (2019). Piano generale dell'impianto di controllo dell'inquinamento idrico. Recupero da sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Additivi negli alimenti degli spagnoli e la legislazione che ne regola l'autorizzazione e l'uso. Libri di visione. Recupero da books.google.co.ve.


Nessun utente ha ancora commentato questo articolo.