
Caratteristiche dei composti quaternari, formazione, esempi
Il composti quaternari Sono tutti quelli che hanno quattro diversi atomi o ioni. Pertanto, possono essere specie molecolari o ioniche. Le loro diversità includono la chimica sia organica che inorganica, essendo un gruppo molto voluminoso; anche se forse non così tanto rispetto ai composti binari o ternari.
La ragione per cui il loro numero è inferiore è perché i quattro atomi o ioni devono essere tenuti insieme dalle loro affinità chimiche. Non tutti gli elementi sono compatibili tra loro, e ancor meno se si considera un quartetto; improvvisamente un paio di loro sono più simili l'uno all'altro che all'altra coppia.
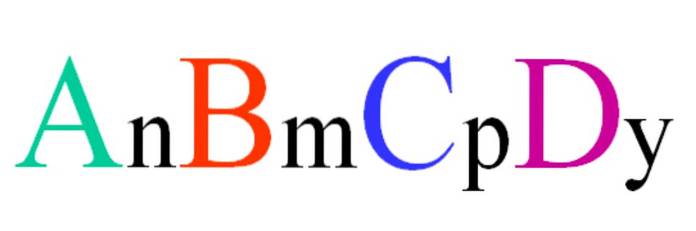
Considera un composto quaternario della formula casuale ABCD. I pedici n, m, p e y sono i coefficienti stechiometrici, che a loro volta indicano quale proporzione di ogni atomo c'è rispetto agli altri..
Pertanto, la formula AnBmCpDY sarà valido se conforme all'elettroneutralità. Inoltre, un tale composto sarà possibile se i suoi quattro atomi sono sufficientemente correlati tra loro. Si vedrà che questa formula non si applica a molti composti, ma soprattutto a leghe o minerali..
Indice articolo
- 1 Caratteristiche dei composti quaternari
- 1.1 Chimica
- 1.2 Fisico
- 2 Nomenclatura
- 2.1 Oxisales acidi
- 2.2 Oxisales di base
- 2.3 Sali doppi
- 2.4 Sali idrati
- 3 Formazione
- 4 esempi
- 5 Riferimenti
Caratteristiche dei composti quaternari
Chimica
Un composto quaternario può essere ionico o covalente, esibendo le caratteristiche previste per la sua natura. I composti ionici ABCD dovrebbero essere solubili in acqua, alcoli o altri solventi polari; dovrebbero avere alti punti di ebollizione e di fusione ed essere buoni conduttori di elettricità una volta sciolti.
Per quanto riguarda i composti ABCD covalenti, la maggior parte è costituita da composti organici azotati, ossigenati o alogenati; cioè, la sua formula diventerebbe CnHmOpNY o CnHmOpXY, dove X è un atomo di alogeno. Di queste molecole sarebbe logico pensare che fossero polari, data l'elevata elettronegatività di O, N e X.
Un composto ABCD puramente covalente può avere molte possibilità di legame: A-B, B-C, D-A, ecc., Ovviamente a seconda delle affinità e delle capacità elettroniche degli atomi. Mentre in un composto ABCD puramente ionico, le sue interazioni sono elettrostatiche: A+B-C+D-, per esempio.
Nel caso di una lega, considerata più una miscela solida che un composto propriamente detto, l'ABCD è costituito da atomi neutri negli stati fondamentali (in teoria).
Del resto, un composto ABCD può essere neutro, acido o basico, a seconda dell'identità dei suoi atomi..
Fisico
Fisicamente parlando, è probabile che ABCD non diventi un gas, poiché quattro diversi atomi implicano sempre una massa molecolare o una formula più elevata. Se non è un liquido ad alto punto di ebollizione, c'è da aspettarsi che sia un solido, la cui decomposizione deve generare molti prodotti.
Ancora una volta, i loro colori, odore, consistenza, cristalli, ecc. Saranno soggetti a come A, B, C e D coesisteranno nel composto e dipenderanno dalla loro sinergia e struttura..
Nomenclatura
Finora la questione dei composti quaternari è stata affrontata in modo globale e impreciso. Tralasciando la chimica organica (ammidi, benzil cloruri, sali di ammonio quaternario, ecc.), Nella chimica inorganica esistono esempi ben definiti chiamati ossisali acidi e basici..
Oxisales acido
Gli ossisali acidi sono quelli che derivano dalla parziale neutralizzazione di un osso acido poliprotico. Pertanto, uno o più dei suoi idrogeni vengono sostituiti da cationi metallici e meno idrogeni rimanenti ha, meno acido sarà..
Ad esempio, dall'acido fosforico, H.3PO4, Si possono ottenere fino a due sali acidi, diciamo, di sodio. Questi sono: NaHDuePO4 (N / A+ sostituisce un idrogeno equivalente a H+) e NaDueHPO4.
Secondo la nomenclatura tradizionale, questi sali sono denominati allo stesso modo degli ossisali (totalmente deprotonati), ma con la parola "acido" che precede il nome del metallo. Pertanto, il NaHDuePO4 sarebbe fosfato diacido di sodio e NaDueHPO4 fosfato acido di sodio (perché gli è rimasta una H).
D'altro canto, la nomenclatura azionaria preferisce utilizzare la parola "idrogeno" piuttosto che "acido". Il NaHDuePO4 diventerebbe quindi sodio diidrogeno fosfato e NaDueHPO4 fosfato di sodio idrogeno. Nota che questi sali hanno quattro atomi: Na, H, P e O.
Oxisales di base
Gli ossisali di base sono quelli che contengono l'anione OH nella loro composizione-. Si consideri ad esempio il sale CaNO3OH (CaDue+ NON3- Oh-). Per nominarlo, basterebbe far precedere la parola "basic" al nome del metallo. Quindi, il suo nome sarebbe: nitrato di calcio di base. E che dire del CuIO3OH? Il suo nome sarebbe: iodato basico rameico (CuDue+ IO3- Oh-).
Secondo la nomenclatura stock, la parola `` base '' è sostituita da idrossido, seguita dall'uso di un trattino prima del nome del oxoanion.
Ripetendo gli esempi precedenti, i loro nomi sarebbero per ciascuno: idrossido di calcio nitrato e idrossido di rame (II) iodato; ricordando che la valenza del metallo va indicata tra parentesi e con numeri romani.
Sali doppi
Nei doppi sali ci sono due diversi cationi che interagiscono con lo stesso tipo di anione. Supponiamo doppio sale: Cu3Fede (PO4)3 (CuDue+ Fede3+ PO43-). È un fosfato di ferro e rame, ma il nome più appropriato per riferirsi a questo è: triplo fosfato di rame (II) e ferro (III).
Sali idrati
Questi sono idrati e l'unica differenza è che il numero di acqua da formulare è specificato alla fine dei loro nomi. Ad esempio, il MnClDue è cloruro di manganese (II).
Il suo idrato, MnClDue4HDueOppure si chiama manganese (II) cloruro tetraidrato. Nota che ci sono quattro diversi atomi: Mn, Cl, H e O.
Un famoso doppio sale idratato è Mohr's, Fe (NH4)Due(SW4)Due6HDueO. Il suo nome è: doppio solfato di ferro (II) e esaidrato di ammonio.
Formazione
Ancora una volta, concentrandosi sui composti quaternari inorganici, sembra che siano principalmente il prodotto di neutralizzazioni parziali. Se questi si verificano in presenza di diversi ossidi metallici, è probabile che si formino doppi sali; e se il mezzo è molto basico, gli ossisali basici precipiteranno.
E se invece le molecole d'acqua hanno un'affinità per il metallo, si coordineranno direttamente con esso o con gli ioni che lo circondano, formando gli idrati.
Sul lato della lega, devono essere saldati quattro diversi metalli o metalloidi per realizzare condensatori, semiconduttori o transistor..
Esempi
Infine, di seguito è riportato un elenco con diversi esempi di composti quaternari. Il lettore può usarlo per testare la propria conoscenza della nomenclatura:
- PbCO3(OH)Due
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- CuDue(OH)DueSW3
- LiDueKAsO4
- CORSO45HDueO
- AgAu (SO4)Due
- Astuccio42HDueO
- FeCl36HDueO
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Nomenclatura e formulazione inorganica. [PDF]. Estratto da: recursostic.educacion.es
- Erika Thalîa Bene. (2019). Sali doppi. Accademia. Estratto da: academia.edu
- Wikipedia. (2019). Catione di ammonio quaternario. Estratto da: en.wikipedia.org


Nessun utente ha ancora commentato questo articolo.