
Struttura, proprietà, usi ed esempi delle aldeidi

Il aldeidi sono composti organici che hanno la formula generale RCHO. R rappresenta una catena alifatica o aromatica; C al carbonio; O all'ossigeno e H all'idrogeno. Sono caratterizzati dall'avere un gruppo carbonile come i chetoni e gli acidi carbossilici, motivo per cui le aldeidi sono anche chiamate composti carbonilici.
Il gruppo carbonile conferisce all'aldeide molte delle sue proprietà. Sono composti facilmente ossidabili e molto reattivi alle aggiunte nucleofile. Il doppio legame del gruppo carbonile (C = O) ha due atomi che hanno differenze nella loro avidità di elettroni (elettronegatività).
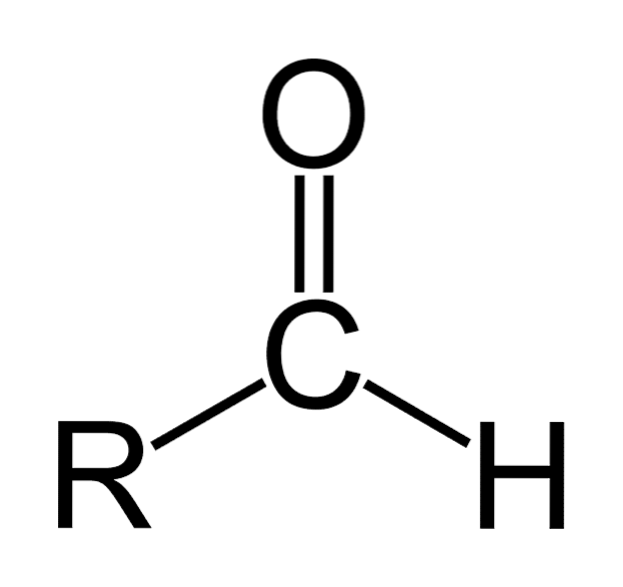
L'ossigeno attrae gli elettroni con una forza maggiore del carbonio, quindi la nuvola di elettroni si muove verso di essa, rendendo il doppio legame tra carbonio e ossigeno di natura polare, con un momento di dipolo significativo. Questo rende le aldeidi composti polari..
La polarità delle aldeidi influenzerà le loro proprietà fisiche. Il punto di ebollizione e la solubilità delle aldeidi in acqua sono superiori ai composti chimici non polari con pesi molecolari simili, come nel caso degli idrocarburi..
Le aldeidi con meno di cinque atomi di carbonio sono solubili in acqua, poiché si formano legami idrogeno tra l'ossigeno del gruppo carbonile e la molecola d'acqua. Tuttavia, l'aumento del numero di atomi di carbonio nella catena degli idrocarburi produce un aumento della porzione non polare dell'aldeide, rendendola meno solubile in acqua..
Ma come sono e da dove vengono? Sebbene la sua natura dipenda essenzialmente dal gruppo carbonile, anche il resto della struttura molecolare contribuisce molto all'insieme. Pertanto, possono essere di qualsiasi dimensione, piccole o grandi, o anche una macromolecola può avere regioni in cui predomina il carattere delle aldeidi..
Così, come con tutti i composti chimici, ci sono aldeidi "piacevoli" e altre amare. Possono essere trovati in fonti naturali o sintetizzati su larga scala. Esempi di aldeidi sono la vanillina, molto presente nei gelati (immagine in alto) e l'acetaldeide, che aggiunge sapore alle bevande alcoliche..
Indice articolo
- 1 Struttura chimica
- 2 Proprietà fisiche e chimiche
- 2.1 Punti di fusione
- 2.2 Punti di ebollizione
- 2.3 Solubilità in acqua espressa in g / 100 g di H2O
- 3 Reattività
- 3.1 Reazione di ossidazione
- 3.2 Riduzione agli alcoli
- 3.3 Riduzione agli idrocarburi
- 3.4 Addizione nucleofila
- 4 Nomenclatura
- 5 Usi
- 5.1 Formaldeide
- 5.2 bachelite
- 5.3 Compensato
- 5.4 Poliuretano
- 5.5 Butirraldeide
- 5.6 Acetaldeide
- 5.7 Sintesi
- 6 Esempi di aldeidi
- 6.1 Glutaraldeide
- 6.2 Benzaldeide
- 6.3 Gliceraldeide
- 6.4 Gliceraldeide-3-fosfato
- 6.5 11-cis-retinale
- 6.6 Piridossal fosfato (vitamina B6)
- 6.7 Salicilaldeide
- 7 Riferimenti
Struttura chimica

Le aldeidi sono costituite da un carbonile (C = O) a cui è direttamente attaccato un atomo di idrogeno. Questo lo differenzia da altri composti organici come i chetoni (RDueC = O) e acidi carbossilici (RCOOH).
L'immagine in alto mostra la struttura molecolare attorno a -CHO, un gruppo formile. Il gruppo formile è piatto perché il carbonio e l'ossigeno hanno l'ibridazione spDue. Questa planarità lo rende suscettibile all'attacco di specie nucleofile, e quindi è facilmente ossidabile..
A cosa si riferisce questa ossidazione? Alla formazione di un legame con qualsiasi altro atomo più elettronegativo del carbonio; e nel caso delle aldeidi è un ossigeno. Pertanto, l'aldeide viene ossidata in un acido carbossilico, -COOH. E se l'aldeide fosse ridotta? Al suo posto si formerebbe un alcol primario, ROH.
Le aldeidi sono prodotte solo da alcoli primari: quelli in cui il gruppo OH si trova alla fine di una catena. Allo stesso modo, il gruppo formile per sempre è all'estremità di una catena o sporge da essa o dall'anello come sostituente (se ci sono altri gruppi più importanti, come -COOH).
Proprietà fisiche e chimiche
Poiché sono composti polari, i loro punti di fusione sono superiori a quelli dei composti non polari. Le molecole di aldeide non sono in grado di legarsi intermolecolari attraverso legami idrogeno, poiché hanno solo atomi di carbonio attaccati agli atomi di idrogeno..
A causa di quanto sopra, le aldeidi hanno punti di ebollizione inferiori rispetto agli alcoli e agli acidi carbossilici.
Punti di fusione
Formaldeide -92; Acetaldeide -121; Propionaldeide -81; n-butirraldeide -99; n-Valeraldeide -91; Caproaldeide -; Eptaldeide - 42; Fenilacetaldeide -; Benzaldeide -26.
Punti di ebollizione
Formaldeide -21; Acetaldeide 20; Aldeide propionica 49; n-butirraldeide 76; n-valeraldeide 103; Caproaldeide 131; Eptaldeide 155; Fenilacetaldeide 194; Benzaldeide 178.
Solubilità in acqua espressa in g / 100 g di HDueO
Formaldeide, molto solubile; Acetaldeide, infinita; Propionaldeide, 16; n-butirraldeide, 7; n-Valeraldeide, leggermente solubile; caproaldeide, leggermente solubile; Fenilacetaldeide leggermente solubile; Benzaldeide, 0,3.
I punti di ebollizione delle aldeidi tendono ad aumentare direttamente con il peso molecolare. Al contrario, si tende a diminuire la solubilità delle aldeidi in acqua all'aumentare del loro peso molecolare. Ciò si riflette nelle costanti fisiche delle aldeidi appena menzionate..
Reattività
Reazione di ossidazione
Le aldeidi possono essere ossidate nel corrispondente acido carbossilico in presenza di uno qualsiasi di questi composti: Ag (NH3)Due, KMnO4 va beneDueCrDueO7.
Riduzione agli alcoli
Possono essere idrogenati con l'ausilio di catalizzatori di nichel, platino o palladio. Quindi, C = O diventa C-OH.
Riduzione agli idrocarburi
In presenza di Zn (Hg), HCl concentrato o NHDueNHDue le aldeidi perdono il gruppo carbonile e diventano idrocarburi.
Addizione nucleofila
Ci sono diversi composti che vengono aggiunti al gruppo carbonile, tra questi sono: reagenti di Grignard, cianuro, derivati di ammoniaca e alcoli.
Nomenclatura
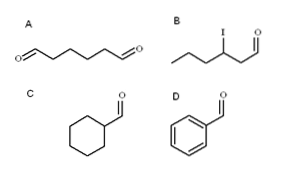
Quattro aldeidi sono illustrate nell'immagine sopra. Come si chiamano?
Poiché sono alcoli primari ossidati, il nome dell'alcool viene modificato da -ol a -al. Pertanto, il metanolo (CH3OH) se ossidato a CH3CHO è chiamato metanale (formaldeide); CH3CHDueCHO etanale (acetaldeide); CH3CHDueCHDueCHO propanale e CH3CHDueCHDueCHDueCHO butanal.
Tutte le nuove aldeidi hanno il gruppo -CHO alla fine della catena. Quando si trova ad entrambe le estremità, come in A, la desinenza -al è anteposta al prefisso di-. Poiché A ha sei atomi di carbonio (contando quelli di entrambi i gruppi formilici), deriva da 1-esanolo e il suo nome è quindi: esanocomporre.
Quando è presente un sostituente, come un radicale alchilico, un doppio o triplo legame o un alogeno, gli atomi di carbonio della catena principale sono elencati dando -CHO il numero 1. Pertanto, l'aldeide B è chiamata: 3-iodoesanale.
Tuttavia, nelle aldeidi C e D il gruppo -CHO non ha la priorità per identificare tali composti da altri. C è un cicloalcano, mentre D un benzene, entrambi con uno dei loro Hs sostituito da un gruppo formile.
In essi, poiché la struttura principale è ciclica, il gruppo formile è chiamato carbaldeide. Quindi, C è cicloesanocarbaldeide e D è benzenecarbaldeide (meglio nota come benzaldeide).
Applicazioni
In natura esistono aldeidi capaci di conferire piacevoli sapori, come nel caso della cinnamaldeide, responsabile del caratteristico sapore della cannella. Questo è il motivo per cui vengono spesso utilizzati come aromi artificiali in molti prodotti come dolci o alimenti..
Formaldeide
La formaldeide è l'aldeide più prodotta industrialmente. La formaldeide ottenuta dall'ossidazione del metanolo viene utilizzata in una soluzione al 37% del gas in acqua, sotto il nome di formalina. Viene utilizzato nella concia delle pelli e nella conservazione e imbalsamazione dei cadaveri..
Allo stesso modo, la formaldeide viene utilizzata come germicida, fungicida e insetticida per piante e ortaggi. Tuttavia, la sua più grande utilità è il contributo alla produzione di materiale polimerico. La plastica chiamata bachelite è sintetizzata dalla reazione tra formaldeide e fenolo.
Bachelite
La bachelite è un polimero altamente duro con una struttura tridimensionale utilizzato in molti utensili domestici come manici per pentole, padelle, caffettiere, coltelli, ecc..
I polimeri simili alla bachelite sono fatti di formaldeide in combinazione con i composti urea e melammina. Questi polimeri sono utilizzati non solo come plastica, ma anche come colle adesive e materiale di rivestimento..
Compensato
Il Compensato è il nome commerciale di un materiale formato da sottili fogli di legno, uniti da polimeri prodotti dalla formaldeide. Con la partecipazione di quest'ultima vengono prodotti i marchi Formica e Melmac. La formica è un materiale plastico utilizzato nel rivestimento dei mobili.
La plastica Melmac viene utilizzata per realizzare piatti, bicchieri, tazze, ecc. La formaldeide è la materia prima per la sintesi del composto metilene-difenil-diisocianato (MDI), un precursore del poliuretano.
Poliuretano
Il poliuretano è utilizzato come isolante in frigoriferi e congelatori, imbottiture per mobili, materassi, rivestimenti, adesivi, suole, ecc..
Butyraldehyde
La butirraldeide è il principale precursore della sintesi del 2-etilesanolo, che viene utilizzato come plastificante. Ha un gradevole aroma di mela che ne consente l'utilizzo negli alimenti come condimento.
Viene anche utilizzato per la produzione di acceleratori di gomma. Interviene come reagente intermedio nella produzione di solventi.
Acetaldeide
L'acetaldeide è stata utilizzata nella produzione di acido acetico. Ma questo ruolo dell'acetaldeide è diminuito di importanza, poiché è stato sostituito dal processo di carbonilazione del metanolo..
Sintesi
Altre aldeidi sono precursori degli oxoalcoli, che vengono utilizzati nella produzione di detergenti. I cosiddetti ossoalcoli vengono preparati aggiungendo monossido di carbonio e idrogeno a un'olefina per ottenere un'aldeide. E infine l'aldeide viene idrogenata per ottenere l'alcol.
Alcune aldeidi sono utilizzate nella produzione di profumi, come nel caso di Chanel n. 5. Molte aldeidi di origine naturale hanno odori gradevoli, ad esempio: l'eptanale ha un odore di erba verde; l'ottanale un odore di arancia; il nonanale un odore di rose e il citrale un odore di lime.
Esempi di aldeidi
Glutaraldeide
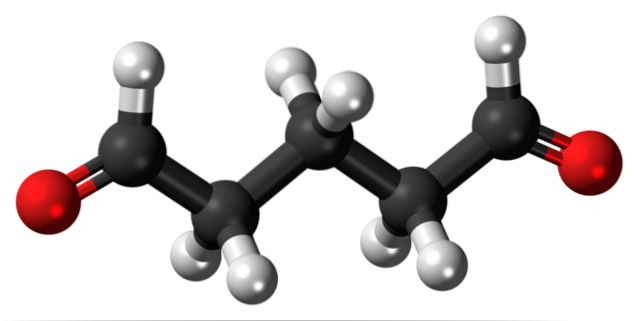
La glutaraldeide ha due gruppi formilici nella sua struttura ad entrambe le estremità.
Commercializzato con il nome di Cidex o Glutaral, viene utilizzato come disinfettante per sterilizzare gli strumenti chirurgici. È usato per trattare le verruche sui piedi, applicandolo come un liquido. È anche usato come agente di fissaggio dei tessuti nei laboratori di istologia e patologia..
Benzaldeide
È l'aldeide aromatica più semplice formata da un anello benzenico a cui è legato un gruppo formile.
Si trova nell'olio di mandorle, da qui il suo odore caratteristico che ne consente l'utilizzo come condimento alimentare. Inoltre, è utilizzato nella sintesi di composti organici legati alla produzione di farmaci e nella produzione di materie plastiche..
Gliceraldeide
È un aldotriosio, uno zucchero composto da tre atomi di carbonio. Ha due isomeri chiamati enantiomeri D e L. La gliceraldeide è il primo monosaccaride ad essere ottenuto nella fotosintesi durante la fase oscura (ciclo di Calvin)..
Gliceraldeide-3-fosfato
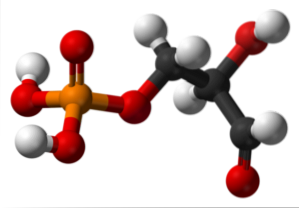
L'immagine in alto illustra la struttura della gliceraldeide-3-fosfato. Le sfere rosse accanto a quella gialla corrispondono al gruppo fosfato, mentre quelle nere lo scheletro di carbonio. La sfera rossa legata a quella bianca è il gruppo OH, ma quando è collegata alla sfera nera e quest'ultima a quella bianca, allora è il gruppo CHO.
La gliceraldeide-3-fosfato è coinvolta nella glicolisi, un processo metabolico in cui il glucosio viene degradato in acido piruvico con la produzione di ATP, un serbatoio di energia degli esseri viventi. Oltre alla produzione di NADH, un agente riducente biologico.
Nella glicolisi, gliceraldeide-3-fosfato e diidroacetone fosfato provengono dalla scissione del D-fruttosio-1-6-bisfosfato
La gliceraldeide-3-fosfato è coinvolta nel processo metabolico noto come ciclo pentoso. In esso viene generato NADPH, un importante riduttore biologico..
11-cis-retinale
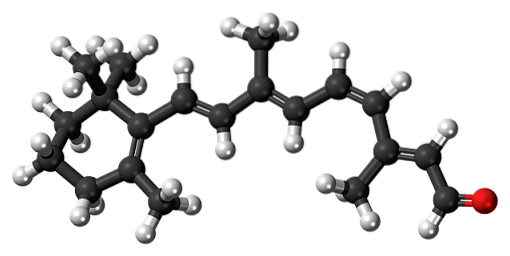
Il Β-carotene è un pigmento naturale presente in varie verdure, in particolare le carote. Subisce una degradazione ossidativa nel fegato, trasformandosi così in alcol retinolo o vitamina A. L'ossidazione della vitamina A e la successiva isomerizzazione di uno dei suoi doppi legami, forma l'aldeide 11-cis-retinica.
Piridossal fosfato (vitamina B6)
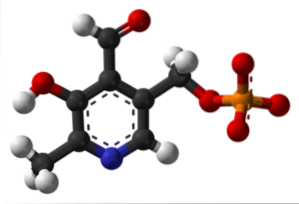
È un gruppo protesico legato a diversi enzimi, che è la forma attiva della vitamina B6 e partecipa al processo di sintesi del neurotrasmettitore inibitorio GABA.
Dov'è il gruppo formile nella tua struttura? Si noti che questo differisce dal resto dei gruppi legati all'anello aromatico.
Salicilaldeide
È una materia prima per la sintesi dell'acido acetilsalicilico, un farmaco analgesico e antipiretico noto come Aspirina..
Riferimenti
- Robert C. Neuman, Jr. Capitolo 13, Composti carbonilici: chetoni, aldeidi, acidi carbossilici. [PDF]. Tratto da: chem.ucr.edu
- Germán Fernández. (14 settembre 2009). Nomenclatura delle aldeidi. Tratto da: quimicaorganica.net
- T.W. Graham Solomons, Craigh B. Fryhle. Chimica organica. (Decima edizione, p. 729-731) Wiley Plus.
- Jerry March e William H. Brown. (31 dicembre 2015). Aldeide. Tratto da: britannica.com
- Wikipedia. (2018). Aldeidi. Tratto da: https://en.wikipedia.org/wiki/Aldehyde
- Morrison, R. T. e Boyd, R. N. (1990). Quinta edizione di chimica organica. Editoriale Addison-Wesley Iberoamericana.
- Carey, F. A. (2006). Sesta edizione di chimica organica. Casa editrice Mc Graw Hill.
- Mathews, Ch. K., Van Holde, K. E. e Athern, K. G. (2002). Biochimica. Terza edizione. Editore Pearson Adisson Wesley.


Nessun utente ha ancora commentato questo articolo.