
Struttura, proprietà, formazione dell'acido bromidrico (HBr)

Il acido bromidrico È un composto inorganico che risulta dalla dissoluzione acquosa di un gas chiamato bromuro di idrogeno. La sua formula chimica è HBr, e può essere considerata in diversi modi equivalenti: come un idruro molecolare, o un alogenuro di idrogeno in acqua; cioè un idracido.
Nelle equazioni chimiche dovrebbe essere scritto come HBr (ac), indicando così che è l'acido bromidrico e non il gas. Questo acido è uno dei più forti conosciuti, ancor più dell'acido cloridrico, HCl. La spiegazione di ciò sta nella natura del suo legame covalente.
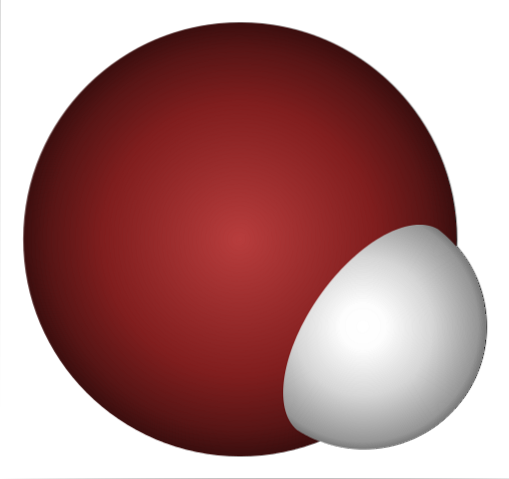
Perché l'HBr è un acido così forte e ancor più disciolto in acqua? Poiché il legame covalente H-Br è molto debole, a causa della scarsa sovrapposizione degli orbitali 1s di H e 4p di Br.
Ciò non sorprende se guardi attentamente l'immagine sopra, dove chiaramente l'atomo di bromo (marrone) è molto più grande dell'atomo di idrogeno (bianco).
Di conseguenza, qualsiasi disturbo provoca la rottura del legame H-Br, rilasciando lo ione H.+. Quindi, l'acido bromidrico è un acido di Brönsted, poiché trasferisce protoni o ioni idrogeno. La sua forza è tale da essere utilizzata nella sintesi di vari composti organobromurati (come 1-Bromo ethane, CH3CHDueBr).
L'acido bromidrico è, dopo idroiodico, HI, uno degli idracidi più potenti e utili per la digestione di alcuni campioni solidi.
Indice articolo
- 1 Struttura dell'acido bromidrico
- 1.1 Acidità
- 2 Proprietà fisiche e chimiche
- 2.1 Formula molecolare
- 2.2 Peso molecolare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Soglia di odore
- 2.6 Densità
- 2.7 Punto di fusione
- 2.8 Punto di ebollizione
- 2.9 Solubilità in acqua
- 2.10 Densità del vapore
- 2.11 Acidità pKa
- 2.12 Capacità calorica
- 2.13 Entalpia molare standard
- 2.14 Entropia molare standard
- 2.15 Punto di infiammabilità
- 3 Nomenclatura
- 4 Come si forma?
- 4.1 Miscela di idrogeno e bromo in acqua
- 4.2 Tribromuro di fosforo
- 4.3 Anidride solforosa e bromo
- 5 Usi
- 5.1 Preparazione dei bromuri
- 5.2 Sintesi di alogenuri alchilici
- 5.3 Catalizzatore
- 6 Riferimenti
Struttura dell'acido bromidrico
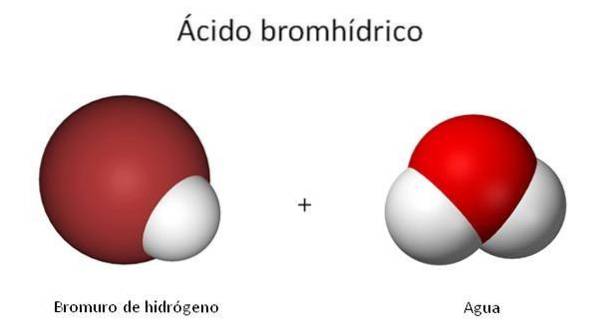
L'immagine mostra la struttura dell'H-Br, le cui proprietà e caratteristiche, anche se sono quelle del gas, sono strettamente legate alle sue soluzioni acquose. Questo è il motivo per cui arriva un punto in cui c'è confusione su quale dei due composti si riferisce a: HBr o HBr (ac).
La struttura di HBr (ac) è diversa da quella di HBr, poiché ora le molecole d'acqua stanno risolvendo questa molecola biatomica. Quando è abbastanza vicino, l'H viene trasferito+ a una molecola di HDueO come indicato nella seguente equazione chimica:
HBr + HDueO => Br-- + H3O+
Pertanto, la struttura dell'acido bromidrico è costituita da ioni Br-- e H.3O+ interagendo elettrostaticamente. Ora, è un po 'diverso dal legame covalente di H-Br.
La sua elevata acidità è dovuta al voluminoso Br anione- riesce a malapena a interagire con l'H3O+, incapace di impedirti di trasferire l'H+ ad un'altra specie chimica circostante.
Acidità
Ad esempio, Cl- e la F- sebbene non formino legami covalenti con H.3O+, possono interagire attraverso altre forze intermolecolari, come i legami idrogeno (che solo F- è in grado di accettarli). Legami idrogeno F--H-OHDue+ "Ostacolare" la donazione di H.+.
È per questo motivo che l'acido fluoridrico, HF, è un acido più debole. in acqua rispetto all'acido bromidrico; da allora, le interazioni ioniche Br- H3O+ non disturbare il trasferimento dell'H+.
Tuttavia, sebbene l'acqua sia presente in HBr (aq), il suo comportamento è in definitiva simile a quello di una molecola di H-Br; cioè una H.+ viene trasferito da HBr o da Br-H3O+.
Proprietà fisiche e chimiche
Formula molecolare
HBr.
Peso molecolare
80,972 g / mol. Si noti che, come accennato nella sezione precedente, viene considerato solo l'HBr e non la molecola d'acqua. Se il peso molecolare fosse preso dalla formula Br-H3O+ avrebbe un valore di circa 99 g / mol.
Aspetto fisico
Liquido incolore o giallo pallido, che dipenderà dalla concentrazione dell'HBr disciolto. Più è giallo, più sarà concentrato e pericoloso.
Odore
Pungente, irritante.
Soglia di odore
6,67 mg / m3.
Densità
1,49 g / cm3 (48% p / p di soluzione acquosa). Questo valore, così come quelli corrispondenti ai punti di fusione e di ebollizione, dipendono dalla quantità di HBr disciolto nell'acqua..
Punto di fusione
-11 ° C (12 ° F, 393 ° K) (49% p / p soluzione acquosa).
Punto di ebollizione
122 ºC (252 ºF. 393 ºK) a 700 mmHg (soluzione acquosa 47-49% p / p).
Solubilità dell'acqua
-221 g / 100 ml (a 0 ° C).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Questi valori si riferiscono all'HBr gassoso, non all'acido bromidrico. Come si può vedere, all'aumentare della temperatura, la solubilità dell'HBr diminuisce; comportamento naturale nei gas. Di conseguenza, se sono necessarie soluzioni concentrate di HBr (aq), è meglio lavorare con esse a basse temperature..
Se si lavora ad alte temperature, l'HBr fuoriesce sotto forma di molecole biatomiche gassose, quindi il reattore deve essere sigillato per evitare la sua fuoriuscita.
Densità del vapore
2,71 (relativo all'aria = 1).
Acidità pKa
-9.0. Questa costante negativa è indicativa della sua grande forza di acidità..
Capacità calorica
29,1 kJ / mol.
Entalpia molare standard
198,7 kJ / mol (298 ºK).
Entropia molare standard
-36,3 kJ / mol.
punto di accensione
Non infiammabile.
Nomenclatura
Il suo nome "acido bromidrico" combina due fatti: la presenza di acqua e quel bromo ha una valenza di -1 nel composto. In inglese è un po 'più ovvio: acido bromidrico, dove il prefisso' hydro '(o hydro) si riferisce all'acqua; sebbene, in realtà, possa riferirsi anche all'idrogeno.
Il bromo ha una valenza di -1 perché è legato a un atomo di idrogeno meno elettronegativo di esso; ma se fosse legato o interagisse con atomi di ossigeno, può avere numerose valenze, come: +2, +3, +5 e +7. Con la H può adottare solo una sola valenza, ed è per questo che al suo nome viene aggiunto il suffisso -ico.
Mentre HBr (g), acido bromidrico, è anidro; cioè non ha acqua. Pertanto, è denominato sotto altri standard di nomenclatura, corrispondenti a quello degli alogenuri di idrogeno..
Come si forma?
Esistono diversi metodi sintetici per preparare l'acido bromidrico. Alcuni di loro sono:
Miscela di idrogeno e bromo in acqua
Senza descrivere i dettagli tecnici, questo acido può essere ottenuto dalla miscelazione diretta di idrogeno e bromo in un reattore riempito d'acqua..
HDue + BrDue => HBr
In questo modo, man mano che si forma l'HBr, si dissolve nell'acqua; questo può trascinarlo nelle distillazioni, quindi si possono estrarre soluzioni con diverse concentrazioni. L'idrogeno è un gas e il bromo è un liquido rossastro scuro.
Tribromuro di fosforo
In un processo più elaborato, sabbia, fosforo rosso idratato e bromo vengono miscelati. Le trappole per l'acqua vengono poste in bagni di ghiaccio per impedire la fuoriuscita di HBr e la formazione di acido bromidrico. Le reazioni sono:
2P + 3BrDue => 2PBr3
PBr3 + 3HDueO => 3HBr + H3PO3
Anidride solforosa e bromo
Un altro modo per prepararlo è reagire il bromo con l'anidride solforosa nell'acqua:
BrDue + SWDue + 2HDueO => 2HBr + HDueSW4
Questa è una reazione redox. Il BRDue riduce, guadagna elettroni, legandosi con gli idrogeni; mentre il SODue si ossida, perde elettroni, quando forma legami più covalenti con altri ossigeni, come nell'acido solforico.
Applicazioni
Preparazione del bromuro
I sali di bromuro possono essere preparati facendo reagire HBr (aq) con un idrossido di metallo. Ad esempio, si considera la produzione di bromuro di calcio:
Ca (OH)Due + 2HBr => CaBrDue + HDueO
Un altro esempio è per il bromuro di sodio:
NaOH + HBr => NaBr + HDueO
Pertanto, molti dei bromuri inorganici possono essere preparati.
Sintesi di alogenuri alchilici
E i bromuri organici? Questi sono composti organobromurati: RBr o ArBr.
Disidratazione alcolica
La materia prima per ottenerli possono essere gli alcoli. Quando sono protonati dall'acidità di HBr, formano l'acqua, che è un buon gruppo uscente, e al suo posto viene incorporato l'ingombrante atomo di Br, che si legherà covalentemente al carbonio:
ROH + HBr => RBr + HDueO
Questa disidratazione viene effettuata a temperature superiori a 100 ° C, con lo scopo di facilitare la rottura del legame R-OH.Due+.
Aggiunta ad alcheni e alchini
La molecola HBr può essere aggiunta dalla sua soluzione acquosa al doppio o triplo legame di un alchene o alchino:
RDueC = CRDue + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
È possibile ottenere diversi prodotti, ma in condizioni semplici, il prodotto si forma principalmente dove il bromo è legato a un carbonio secondario, terziario o quaternario (regola di Markovnikov).
Questi alogenuri sono coinvolti nella sintesi di altri composti organici e la loro gamma di usi è molto ampia. Allo stesso modo, alcuni di essi possono anche essere utilizzati nella sintesi o nella progettazione di nuovi farmaci..
Scissione dell'etere
Dagli eteri si possono ottenere contemporaneamente due alogenuri alchilici, ciascuno portante una delle due catene laterali R o R 'dell'etere iniziale R-O-R'. Succede qualcosa di simile alla disidratazione degli alcoli, ma il loro meccanismo di reazione è diverso.
La reazione può essere delineata con la seguente equazione chimica:
ROR '+ 2HBr => RBr + R'Br
E viene rilasciata anche l'acqua.
Catalizzatore
La sua acidità è tale da poter essere utilizzato come efficace catalizzatore acido. Invece di aggiungere l'anione Br- alla struttura molecolare, lascia il posto a un'altra molecola per farlo.
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: acido bromidrico. Estratto da: chem.ucla.edu
- Wikipedia. (2018). Acido bromidrico. Estratto da: en.wikipedia.org
- PubChem. (2018). Acido bromidrico. Estratto da: pubchem.ncbi.nlm.nih.gov
- Istituto nazionale di sicurezza e igiene sul lavoro. (2011). Bromuro di idrogeno. [PDF]. Recupero da: insht.es
- PrepChem. (2016). Preparazione dell'acido bromidrico. Estratto da: prepchem.com


Nessun utente ha ancora commentato questo articolo.