
Caratteristiche, prodotti, esempi di reazione di neutralizzazione

UN reazione di neutralizzazione È quello che si verifica tra una specie acida e una basica in modo quantitativo. In generale, in questo tipo di reazione in un mezzo acquoso, acqua e un sale (specie ioniche composte da un catione diverso da H+ e un anione diverso da OH- o ODue-) secondo la seguente equazione: acido + base → sale + acqua.
Gli elettroliti hanno un impatto su una reazione di neutralizzazione, che sono quelle sostanze che, una volta disciolte in acqua, generano una soluzione che consente la conducibilità elettrica. Acidi, basi e sali sono considerati elettroliti.

In questo modo, gli elettroliti forti sono quelle specie che si dissociano completamente nei loro ioni costituenti quando sono in soluzione, mentre gli elettroliti deboli sono solo parzialmente ionizzati (hanno una capacità inferiore di condurre una corrente elettrica; cioè, non sono buoni conduttori come elettroliti forti).
Indice articolo
- 1 Caratteristiche
- 1.1 Titolazioni acido-base
- 2 esempi
- 2.1 Acido forte + base forte
- 2.2 Acido forte + base debole
- 2.3 Acido debole + base forte
- 2.4 Acido debole + base debole
- 3 Riferimenti
Caratteristiche
In primo luogo è da sottolineare che se si avvia una reazione di neutralizzazione con quantità uguali di acido e base (in moli), al termine di detta reazione si ottiene un solo sale; cioè non ci sono quantità residue di acido o base.
Inoltre, una proprietà molto importante delle reazioni acido-base è il pH, che indica quanto sia acida o basica una soluzione. Questo è determinato dalla quantità di ioni H.+ trovato nelle soluzioni misurate.
D'altra parte, ci sono diversi concetti di acidità e basicità a seconda dei parametri che vengono presi in considerazione. Un concetto che spicca è quello di Brønsted e Lowry, che considerano un acido una specie in grado di donare protoni (H+) e una specie di base in grado di accettarli.
Titolazioni acido-base
Per studiare adeguatamente e quantitativamente una reazione di neutralizzazione tra un acido e una base, viene applicata una tecnica chiamata titolazione acido-base (o titolazione)..
Le titolazioni acido-base consistono nel determinare la concentrazione di acido o base necessaria per neutralizzare una certa quantità di base o acido di concentrazione nota.
In pratica, una soluzione standard (la cui concentrazione è nota esattamente) deve essere aggiunta gradualmente alla soluzione la cui concentrazione è sconosciuta fino a raggiungere il punto di equivalenza, dove una delle specie ha completamente neutralizzato l'altra..
Il punto di equivalenza viene rilevato dal violento cambiamento di colore dell'indicatore che è stato aggiunto alla soluzione di concentrazione sconosciuta quando la reazione chimica tra le due soluzioni è stata completata..
Ad esempio, nel caso della neutralizzazione dell'acido fosforico (H.3PO4) ci sarà un punto di equivalenza per ogni protone che viene rilasciato dall'acido; ovvero, ci saranno tre punti di equivalenza e verranno osservati tre cambiamenti di colore.
Prodotti di una reazione di neutralizzazione
Nelle reazioni di un acido forte con una base forte avviene la completa neutralizzazione della specie, come nella reazione tra acido cloridrico e idrossido di bario:
2HCl (aq) + Ba (OH)Due(ac) → BaClDue(aq) + 2HDueO (l)
Quindi non vengono generati ioni H+ u OH- in eccesso, il che significa che il pH delle soluzioni elettrolitiche forti che sono state neutralizzate è intrinsecamente correlato al carattere acido dei loro reagenti.
Al contrario, nel caso di neutralizzazione tra un elettrolita debole e uno forte (acido forte + base debole o acido debole + base forte), si ottiene la dissociazione parziale dell'elettrolita debole e la costante di dissociazione acida (Kper) o la base (Kb) debole, per determinare il carattere acido o basico della reazione netta calcolando il pH.
Ad esempio, abbiamo la reazione tra acido cianidrico e idrossido di sodio:
HCN (aq) + NaOH (aq) → NaCN (aq) + HDueO (l)
In questa reazione, l'elettrolita debole non si ionizza notevolmente nella soluzione, quindi l'equazione ionica netta è rappresentata come segue:
HCN (aq) + OH-(ac) → CN-(ac) + HDueO (l)
Questo si ottiene dopo aver scritto la reazione con elettroliti forti nella loro forma dissociata (Na+(ac) + OH-(ac) sul lato reagente e Na+(ac) + CN-(ac) sul lato dei prodotti), dove solo lo ione sodio è un passante.
Infine, nel caso della reazione tra un acido debole e una base debole, detta neutralizzazione non si verifica. Questo perché entrambi gli elettroliti si dissociano parzialmente, senza produrre l'acqua e il sale previsti..
Esempi
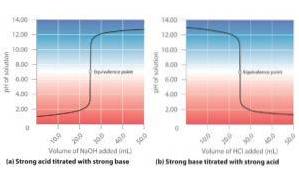
Acido forte + base forte
La reazione data tra acido solforico e idrossido di potassio in mezzo acquoso è presa come esempio, secondo la seguente equazione:
HDueSW4(aq) + 2KOH (aq) → KDueSW4(aq) + 2HDueO (l)
Si può vedere che sia l'acido che l'idrossido sono elettroliti forti; pertanto, ionizzano completamente in soluzione. Il pH di questa soluzione dipenderà dal forte elettrolita che è nella proporzione più alta.
Acido forte + base debole
La neutralizzazione dell'acido nitrico con l'ammoniaca produce il composto nitrato di ammonio, come mostrato di seguito:
HNO3(ac) + NH3(ac) → NH4NON3(AC)
In questo caso l'acqua prodotta insieme al sale non viene osservata, perché dovrebbe essere rappresentata come:
HNO3(ac) + NH4+(ac) + OH-(ac) → NH4NON3(ac) + HDueO (l)
Quindi l'acqua può essere vista come un prodotto di reazione. In questo caso, la soluzione avrà un pH essenzialmente acido.
Acido debole + base forte
Di seguito è mostrata la reazione che si verifica tra acido acetico e idrossido di sodio:
CH3COOH (aq) + NaOH (aq) → CH3COONa (ac) + H.DueO (l)
Poiché l'acido acetico è un elettrolita debole, si dissocia parzialmente, producendo acetato di sodio e acqua, la cui soluzione avrà un pH basico..
Acido debole + base debole
Infine e come accennato in precedenza, una base debole non può neutralizzare un acido debole; né accade il contrario. Entrambe le specie vengono idrolizzate in soluzione acquosa e il pH della soluzione dipenderà dalla "forza" dell'acido e della base..
Riferimenti
- Wikipedia. (s.f.). Neutralizzazione (chimica). Estratto da en.wikipedia.org
- Chang, R. (2007). Chemistry, Nona edizione (McGraw-Hill).
- Raymond, K. W. (2009). Chimica organica e biologica generale. Recupero da books.google.co.ve
- Joesten, M. D., Hogg, J. L. e Castellion, M. E. (2006). Il mondo della chimica: elementi essenziali. Recupero da books.google.co.ve
- Clugston, M. e Flemming, R. (2000). Chimica avanzata. Recupero da books.google.co.ve
- Reger, D. L., Goode, S. R. e Ball, D. W. (2009). Chimica: principi e pratica. Recupero da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.