
Struttura, proprietà, usi del cloruro di sodio (NaCl)
Il cloruro di sodio, Chiamato anche sale comune o sale da tavola, è un sale inorganico binario del sodio metallico alcalino e del cloro alogeno. È il più grande componente del sale commestibile e la sua forma minerale è nota come alite. La sua formula molecolare è NaCl e descrive il rapporto stechiometrico dei suoi ioni (Na+ Cl-) e non quello di una molecola discreta (Na-Cl)
Il cloruro di sodio è un solido cristallino bianco che si forma dalla combinazione di sodio, un metallo bianco argenteo, che reagisce violentemente con l'acqua, e l'elemento cloro, un gas velenoso, corrosivo e di colore verde chiaro..

Una porzione di cristalli di NaCl è mostrata nell'immagine in alto. Com'è possibile che due elementi pericolosi come Na e ClDue, si può formare un sale commestibile? Innanzitutto, l'equazione chimica per la sua formazione è:
2Na (s) + ClDue(g) => 2NaCl (s)
La risposta sta nella natura del legame in NaCl. Essendo ionico, le proprietà del Na+ e Cl- sono diagonalmente differenti dai loro atomi neutri.
Il sodio è un elemento vitale, ma nella sua forma ionica. Poi un+ è il principale catione extracellulare con una concentrazione di circa 140 mEq / l, e insieme ai suoi anioni compagni, Cl- e l'HCO3- (bicarbonato), sono i principali responsabili del valore dell'osmolarità e del volume extracellulare.
Inoltre, il Na+ è responsabile della generazione e conduzione dell'impulso nervoso negli assoni neuronali, nonché dell'avvio della contrazione muscolare.
Il NaCl è stato utilizzato fin dall'antichità per aromatizzare i cibi e per conservare la carne, grazie alla sua capacità di uccidere i batteri e prevenirne il deterioramento.
È inoltre necessario per la produzione di idrossido di sodio (NaOH) e cloro molecolare (ClDue), reagendo NaCl con acqua sotto idrolisi:
2HDueO (l) + 2 NaCl (s) => 2NaOH (aq) + ClDue(g) + HDue(g)
Nel catodo (-) si accumula l'HDue (g) e NaOH. Nel frattempo, nell'anodo (+) si accumula il ClDue (g). L'idrossido di sodio viene utilizzato nella produzione di saponi e il cloro nella produzione di plastica in PVC.
Indice articolo
- 1 Struttura del cloruro di sodio
- 1.1 Cella unitaria
- 2 Proprietà
- 2.1 Formula molecolare
- 2.2 Peso molecolare
- 2.3 Descrizione fisica
- 2.4 Colore
- 2.5 Aroma
- 2.6 Punto di ebollizione
- 2.7 Punto di fusione
- 2.8 Solubilità in acqua
- 2.9 Solubilità in solventi organici
- 2.10 Densità
- 2.11 Pressione di vapore
- 2.12 Stabilità
- 2.13 Decomposizione
- 2.14 Viscosità
- 2.15 Corrosione
- 2,16 pH
- 3 usi
- 3.1 Nel cibo
- 3.2 Usi industriali
- 3.3 A casa
- 3.4 Altri usi
- 3.5 Usi terapeutici
- 4 Tossicità
- 4.1 Ingestione
- 4.2 Irritazione e contatto fisico
- 5 Riferimenti
Struttura del cloruro di sodio
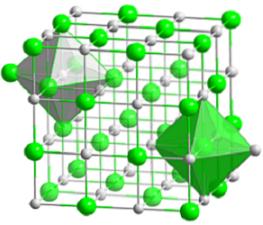
L'immagine in alto rappresenta la struttura cubica compatta del cloruro di sodio. Le voluminose sfere verdi corrispondono agli anioni Cl-, mentre i bianchi, ai Na cationi+. Nota come il cristallo NaCl è costituito da una rete di ioni organizzati dalle loro interazioni elettrostatiche in un rapporto 1: 1..
Sebbene le barre siano mostrate nell'immagine, i legami non sono covalenti ma ionici. L'uso delle barre è utile quando si mostra la geometria di coordinazione attorno a uno ione. Ad esempio, nel caso di NaCl ogni Na+ è circondato da sei Cl- (ottaedro bianco), e ogni Cl- di sei Na+ (ottaedro verde).
Pertanto, ha una coordinazione (6,6) i cui numeri indicano quanti vicini circondano ogni ione. Il numero a destra indica i vicini del Na+, mentre quello di sinistra, quelli del Cl-.
Altre rappresentazioni omettono l'uso di barre per evidenziare i fori ottaedrici nella struttura, che risultano dallo spazio interstiziale tra sei anioni Cl.- (o Na cationi+) confezionato. Questa disposizione è osservata in altri sali inorganici mono (MX) o poliatomici ed è chiamata sale gemma.
Cella unitaria
La cella unitaria del salgemma è cubica, ma quali cubi la rappresentano esattamente nell'immagine sopra? Gli ottaedri danno la risposta. Entrambi coprono una cella totale composta da quattro piccoli cubi.
Questi cubi hanno parti degli ioni ai loro vertici, bordi e facce. Guardando da vicino, uno ione Na+ si trova al centro e dodici sui bordi. Uno ione su un bordo può essere condiviso da quattro cubi. Quindi ci sono 4 ioni Na+ (12 × 1/4 + 1 = 4).
Per ioni Cl-, otto si trovano ai vertici e sei ai bordi. Poiché gli ioni posizionati ai vertici condividono lo spazio con altri otto cubi e ai bordi con sei, abbiamo 4 ioni Cl- (8 × 1/8 + 6 × 1/2 = 4).
Il risultato di cui sopra è interpretato come segue: nella cella unitaria di NaCl ci sono quattro Na cationi+ e quattro anioni Cl-; proporzione che concorda con la formula chimica (a Na+ per ogni Cl-).
Proprietà
Formula molecolare
NaCl.
Peso molecolare
58,44 g / mol.
Descrizione fisica
Un solido cristallino.
Colore
Cristalli incolori trasparenti o polvere cristallina bianca.
Gusto
Salato.
Punto di ebollizione
Da 2.575ºF a 760 mmHg.
1.465 ºC.
Punto di fusione
1.474 ºF (800,7 ºC).
Sia il punto di ebollizione che il punto di fusione riflettono il calore necessario per superare l'energia del reticolo cristallino. Pertanto, queste misurazioni confermano il carattere ionico di NaCl..
Solubilità dell'acqua
Maggiore o uguale a 100 mg / ml a 68ºF.
36,0 g / 100 ml a 25 ° C.
Si tratta infatti di un sale igroscopico, che trattiene l'umidità dall'ambiente.
Solubilità in solventi organici
0,065 g / 100 mL di etanolo a 25 ° C; 10 g / 100 g di glicerolo a 25 ° C; 2,15 g / 100 mL di ammoniaca liquida a 40 ° C; 1,4 g / 100 mL di metanolo a 25 ° C; 7,15 g / 100 di glicole etilenico a 25 ° C e 5,21 g / 100 g di acido formico a 25 ° C.
Densità
2.165 g / cm3 a 77 ºC.
Pressione del vapore
1 mmHg a 1.589ºF.
Stabilità
Stabile nelle condizioni di conservazione consigliate.
Decomposizione
Se riscaldato ad alte temperature, si decompone emettendo acido cloridrico e vapori di ossido di disodio..
Viscosità
Viscosità delle soluzioni sature 1,93 mPa-s.
Corrosione
È corrosivo per molti metalli.
pH
Da 6,7 a 7,3 in soluzione acquosa.
Applicazioni
Nel cibo
-Il cloruro di sodio è stato utilizzato fin dall'antichità per migliorare il gusto dei cibi e per conservarli. Salare la carne è un modo per preservarla dall'azione batterica, poiché ritarda la disgregazione delle proteine.
-Il sale invece aumenta l'osmolarità attorno alla carne, che provoca l'assorbimento per osmosi dell'acqua dei batteri, provocandone l'eliminazione.
Usi industriali
Industria alimentare
-Nell'industria alimentare, il sale viene utilizzato come esaltatore di sapidità, additivo per il controllo della fermentazione, agente per il controllo della consistenza e sviluppatore del colore. Ad esempio, il sale viene aggiunto per far risaltare il colore di pancetta, prosciutto e altri prodotti a base di carne..
-Il sale serve come legante nella preparazione delle salsicce. Contribuisce alla formazione di un gel legante composto da carne, grasso e umidità.
-Nella lavorazione della farina per la panificazione, il sale viene aggiunto durante la cottura per controllare la velocità di lievitazione dell'impasto del pane. Viene anche utilizzato per rafforzare il glutine e come esaltatore di sapidità, nonché come ripieno nei prodotti da forno.
-Viene utilizzato nella produzione di cereali per la colazione, farine miste o preparate, patatine fritte, alimenti per cani e gatti, ecc..
Sintesi di sostanze chimiche
-Il cloruro di sodio è utilizzato come materia prima nella produzione di idrossido di sodio e cloro, che a loro volta sono utili in molte industrie chimiche.
-Il sale viene utilizzato nella lavorazione di vari metalli, ad esempio alluminio, rame, acciaio e vanadio. Viene anche usato per produrre il clorato di sodio, che viene successivamente utilizzato nella sintesi del biossido di cloro, una candeggina a base di ossigeno. Il biossido di cloro è meno dannoso per l'ambiente rispetto ad altre candeggine.
Nell'industria della pelle
-Il sale viene utilizzato per inibire l'azione batterica all'interno della pelle, oltre che per favorire la sua reidratazione.
Nell'industria tessile
-Il sale è usato come mordente nella tintura dei tessuti. Viene utilizzato come risciacquo con salamoia per rimuovere contaminanti organici e per creare una carica positiva sulla superficie dei tessuti che consente l'adesione di coloranti caricati negativamente.
Nell'industria petrolifera
-Nell'esplorazione di petrolio e gas, il sale è una componente importante dei fluidi di perforazione dei pozzi. Viene utilizzato per flocculare e aumentare la densità dei liquidi di perforazione, che permette di superare le elevate pressioni di gas nei pozzi da raggiungere. Inoltre, il sale mantiene la saturazione del liquido di perforazione.
-Il sale aiuta a compattare il terreno su cui sono costruite le strade. Riduce lo spostamento sotterraneo causato dai cambiamenti di umidità e dal traffico automobilistico.
Dentro casa
Il sale è stato usato strofinando per pulire superfici, pentole e padelle. Anche nella prevenzione delle muffe e come smacchiatore. Viene anche utilizzato in molte marche di shampoo e dentifricio..
Altri usi
Sulla strada
-In previsione delle nevicate, le strade sono ricoperte di salamoia, che impedisce al ghiaccio di legarsi alla superficie stradale. Per lo scongelamento, viene utilizzata una miscela di salamoia e sale e talvolta vengono aggiunti altri componenti chimici come magnesio o cloruro di calcio. L'uso di sale e salamoia non è efficace a temperature inferiori a -10 ºC.
L'aggiunta di sale produce una diminuzione del punto crioscopico, proprietà colligativa delle soluzioni, ostacolando così in un certo modo la formazione di ghiaccio..
-A causa della sua condizione igroscopica, il sale viene utilizzato come essiccante economico.
Nelle resine utilizzate per addolcire l'acqua
L'acqua dura contiene ioni di calcio e magnesio che ostacolano l'azione del sapone e provocano depositi di materiali alcalini su varie apparecchiature e tubi. Nell'addolcimento dell'acqua vengono utilizzate resine a scambio ionico. Il sale è utilizzato nella preparazione e rigenerazione delle resine.
Negli estintori
Il cloruro di sodio viene utilizzato negli estintori per combattere gli incendi in cui sono presenti metalli combustibili, come magnesio, potassio, sodio e leghe NK..
Il sale funge da dissipatore di calore e forma anche una crosta che limita l'accesso dell'ossigeno al fuoco..
Negli occhiali
I cristalli di cloruro di sodio sono utilizzati in componenti ottici come finestre e prismi, in particolare per la luce a infrarossi. Tuttavia, poiché il sale è molto igroscopico, si produce una sorta di brina che copre le lenti. Per questo motivo, le lenti al cloruro di sodio sono state sostituite da lenti al seleniuro di zinco (ZnSe)..
Usi terapeutici
Compensa la mancanza di sali nel corpo
-Quando c'è un esaurimento corporeo di Na+, deve essere sostituito per mantenere l'osmolarità extracellulare, la conduzione nervosa e la contrazione muscolare.
-NaCl è utilizzato nel trattamento e nella prevenzione della carenza di sodio e cloro, derivante dall'eccessiva sudorazione durante l'esposizione ad alte temperature. Viene anche utilizzato in una diuresi eccessiva o una limitazione eccessiva dell'assunzione di soluzione salina.
-La somministrazione parenterale di una soluzione di NaCl allo 045% viene utilizzata nella gestione del diabete iperosmolare. Svolge una funzione reidratante e serve per valutare lo stato della funzionalità renale.
-Iniezioni di soluzioni ipertoniche, con una concentrazione di NaCl superiore allo 0,9% p / v,
-Sono usati quando c'è una grave deplezione di Na+, essendo un ripristino dello ione essenziale. Questa iponatriemia può essere la conseguenza di un trattamento con elettroliti liberi o con una concentrazione di Na+.
L'iponatriemia può anche essere causata da un'eccessiva assunzione di acqua, non controllata da una funzione renale inadeguata..
In trattamenti e usi non convenzionali
-Le soluzioni per inalazione di NaCl vengono utilizzate per diluire i farmaci utilizzati durante il processo di nebulizzazione. Viene anche utilizzato per il lavaggio e l'irrigazione tracheale. Soluzione salina allo 0,9% utilizzata negli spray nasali.
-Le soluzioni di NaCl al 20% vengono utilizzate per l'installazione transaddominale intra-amniotica, inducendo così un aborto tardivo durante il secondo trimestre di gravidanza..
-Il cloruro di sodio può essere usato come antisettico locale. Grazie alla sua capacità osmotica è in grado di disidratare un ampio spettro di virus e batteri allo stato non saturo; pertanto, è usato come antisettico doloroso per disinfettare le ferite.
Tossicità
Ingestione
Ha un effetto dannoso sulla salute solo se l'assunzione è elevata e per lungo tempo. In queste circostanze si manifesterebbe ipernatriemia con conseguente aumento del volume extracellulare che porterebbe ad ipertensione arteriosa..
Irritazione e contatto fisico
Ha un effetto tossico solo se l'inalazione è molto elevata. Un contatto eccessivo con la pelle può renderla secca. Infine, provoca una momentanea irritazione al contatto con gli occhi.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione., Pp. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p 482-483.
- Cloruro di sodio. (2018). Cloruro di sodio: benefici, usi, proprietà, rischi. Tratto da: cloruro di sodio.org
- PubChem. (2018). Cloruro di sodio. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Cloruro di sodio. Tratto da: en.wikipedia.org
- Elementi americani. (2018). Cloruro di sodio. Tratto da: americanelements.com



Nessun utente ha ancora commentato questo articolo.