
Struttura, proprietà, usi dell'acetonitrile (C2H3N)
Il acetonitrile È una sostanza di origine organica composta solo da carbonio, idrogeno e azoto. Questa specie chimica appartiene al gruppo dei nitrili, essendo l'acetonitrile quella con la struttura più semplice tra quelle di tipo organico..
I nitrili sono una classe di composti chimici la cui struttura è costituita da un gruppo cianuro (CN-) e una catena radicale (-R). Questi elementi sono rappresentati dalla seguente formula generale: R-C≡N.
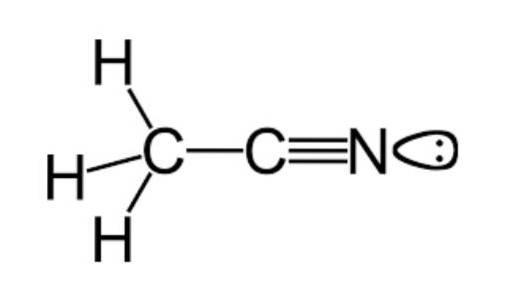
È noto che questa sostanza è originata principalmente durante la produzione di un'altra specie chiamata acrilonitrile (un altro nitrile semplice, di formula molecolare C3H3N, che viene utilizzato nella fabbricazione di prodotti nell'industria tessile) come sottoprodotto della stessa.
Inoltre, l'acetonitrile è considerato un solvente con proprietà di polarità media, motivo per cui viene utilizzato abbastanza regolarmente nelle analisi RP-HPLC (cromatografia liquida ad alte prestazioni in fase inversa)..
Indice articolo
- 1 Struttura
- 2 Proprietà
- 3 usi
- 4 Rischi
- 5 Riferimenti
Struttura
Come accennato in precedenza, l'acetonitrile appartiene al gruppo funzionale dei nitrili, avente una formula molecolare comunemente rappresentata come CDueH3N, che può essere visto nella formula strutturale che è esemplificata nella figura in alto.
Questa immagine mostra una specie di lobo attaccato all'atomo di azoto, che rappresenta la coppia di elettroni spaiati che ha questo atomo e che gli conferiscono gran parte delle proprietà di reattività e stabilità che sono caratteristiche di esso..
In questo modo, questa specie mostra un comportamento molto particolare dovuto alla sua disposizione strutturale, che si traduce in debolezza a ricevere legami idrogeno e scarsa capacità di donare elettroni..
Inoltre, questa sostanza è nata per la prima volta nella seconda metà del 1840, essendo prodotta dallo scienziato di nome Jean-Baptiste Dumas, la cui nazionalità era francese.
La conformazione strutturale di questa sostanza le consente di avere le caratteristiche del proprio solvente di natura organica..
A sua volta, questa proprietà consente di miscelare l'acetonitrile con l'acqua, nonché una serie di altri solventi di origine organica, ad eccezione degli idrocarburi o delle specie idrocarburiche di tipo saturo..
Proprietà
Questo composto ha una serie di proprietà che lo distinguono dagli altri della sua stessa classe, elencati di seguito:
- È allo stato liquido di aggregazione in condizioni standard di pressione e temperatura (1 atm e 25 ° C).
- La sua configurazione molecolare gli conferisce una massa molare o un peso molecolare di circa 41 g / mol.
- È considerato come il nitrile che ha la struttura più semplice, tra il tipo organico.
- Le sue proprietà ottiche gli permettono di essere incolore in questa fase liquida e con caratteristiche limpide, oltre ad avere un odore aromatico..
- Ha un punto di infiammabilità di circa 2 ° C, che è equivalente a 35,6 ° F o 275,1 K..
- Ha un punto di ebollizione compreso tra 81,3 e 82,1 ° C, una densità di circa 0,786 g / cm3 e un punto di fusione compreso tra -46 e -44 ° C.
- È meno denso dell'acqua ma miscibile con essa e con una varietà di solventi organici.
- Mostra una costante dielettrica di 38,8 oltre a un momento di dipolo di circa 3,92 D.
- È in grado di sciogliere una grande varietà di sostanze di origine ionica e di natura non polare.
- È ampiamente utilizzato come fase mobile nell'analisi HPLC, che ha elevate proprietà di infiammabilità.
Applicazioni
Tra il gran numero di applicazioni che ha acetonitrile, si possono annoverare le seguenti:
- Allo stesso modo, altre specie di nitrili possono subire un processo di metabolizzazione nei microsomi (elementi vescicolari che fanno parte del fegato), soprattutto in questo organo, per produrre acido cianidrico..
- È ampiamente utilizzato come fase mobile nel tipo di analisi denominato cromatografia liquida ad alte prestazioni in fase inversa (RP-HPLC); cioè come una sostanza eluente che ha un'elevata stabilità, un grande potere eluente e una bassa viscosità.
- Nel caso di applicazioni di portata industriale, questo composto chimico viene utilizzato nelle raffinerie di petrolio greggio come solvente in alcuni processi, come la purificazione dell'alchene chiamato butadiene..
- Viene anche utilizzato come ligando (specie chimica che si combina con un atomo di un elemento metallico, considerato centrale nella molecola data, per formare un composto o complesso di coordinazione) in un gran numero di composti nitrilici con metalli del gruppo di transizione.
- Allo stesso modo, viene utilizzato nella sintesi organica per un gran numero di sostanze chimiche vantaggiose come l'acido α-naftalene acetico, la tiamina o l'acetamidina cloridrato..
Rischi
I rischi associati all'esposizione all'acetonitrile sono diversi. Tra queste vi è una tossicità ridotta quando l'esposizione è per un periodo di tempo ridotto e in quantità ridotte, essendo metabolizzata per la produzione di acido cianidrico..
Allo stesso modo, raramente sono stati registrati casi di persone che sono state avvelenate con questa specie chimica, essendo state avvelenate dal cianuro presente nella molecola dopo essere state a contatto con acetonitrile in gradi diversi (se inalate, ingerite o assorbite attraverso la pelle).
Per questo motivo, le conseguenze della sua tossicità vengono ritardate perché il corpo non metabolizza facilmente questa sostanza in cianuro, poiché occorrono dalle due alle dodici ore perché ciò avvenga..
Tuttavia, l'acetonitrile è facilmente assorbito dai polmoni e dal tratto gastrointestinale. Successivamente, la sua distribuzione avviene in tutto il corpo, avvenendo nelle persone e persino negli animali e raggiungendo i reni e la milza..
D'altra parte, oltre ai rischi di infiammabilità che presenta, l'acetonitrile è un precursore di sostanze tossiche come l'acido cianidrico o la formaldeide. Il suo utilizzo nei prodotti appartenenti all'area cosmetica è stato addirittura vietato nel cosiddetto Spazio economico europeo nel 2000..
Riferimenti
- Wikipedia. (s.f.). Acetonitrile. Estratto da en.wikipedia.org
- PubChem. (s.f.). Acetonitrile. Recupero da pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Progressi nella cromatografia. Ottenuto da books.google.co.ve
- ScienceDirect. (s.f.). Acetonitrile. Estratto da sciencedirect.com
- ChemSpider. (s.f.). Acetonitrile. Estratto da chemspider.com



Nessun utente ha ancora commentato questo articolo.