
Struttura, proprietà, usi e rischi dell'acetato di ammonio
Il acetato di ammonio è un sale inorganico la cui formula chimica è NH4CH3COOH. È derivato da una miscela di acido acetico, presente nell'aceto commerciale ad una concentrazione del 5%, e ammoniaca. Entrambe le sostanze di partenza hanno odori caratteristici, quindi è possibile farsi un'idea del perché questo sale odora di aceto-ammoniaca.
Tuttavia, l'aspetto più notevole di questo sale non è il suo odore, ma il suo basso punto di fusione. È così basso che in qualsiasi laboratorio potrebbe essere ottenuto nella sua versione liquida, dove gli ioni fluiscono liberamente per trasportare le cariche elettriche..

D'altra parte, l'acetato di ammonio è deliquescente; cioè, assorbe acqua o umidità dall'ambiente fino a quando non si dissolve completamente. Ecco perché, sebbene allo stato anidro i suoi cristalli siano bianchi, diventano rapidamente luminosi (come quelli nel becher nell'immagine sopra).
Essendo una fonte solida di ammoniaca, deve essere maneggiata in modo da ridurre al minimo l'inalazione dei suoi vapori. Ma, nonostante questa caratteristica negativa, l'NH4CH3COOH è utile per la preparazione di soluzioni tampone che conservano gli alimenti, oltre ad essere un componente di alcuni solventi per l'estrazione di proteine.
Indice articolo
- 1 Struttura dell'acetato di ammonio
- 1.1 Altre composizioni e acqua
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Densità
- 2.4 Punto di fusione
- 2.5 Solubilità
- 2.6 Stabilità
- 2.7 pKa
- 2.8 Entalpia di formazione standard
- 3 usi
- 3.1 Analitico
- 3.2 Conduttore medio
- 3.3 Buffer
- 3.4 Su ghiaccio e suolo
- 3.5 Agente precipitante
- 3.6 Medicina
- 4 Rischi
- 5 Riferimenti
Struttura dell'acetato di ammonio
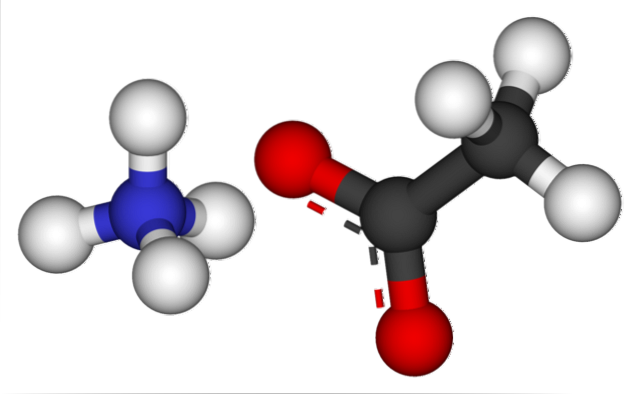
L'immagine sopra mostra gli ioni che compongono l'acetato di ammonio in un modello di sfere e aste. A sinistra è il catione della geometria tetraedrica, NH4+, mentre alla sua destra l'anione molecolare con due elettroni delocalizzati tra due atomi di ossigeno, CH3COO- (la linea tratteggiata tra le sfere rosse).
Quindi entrambi gli ioni, NH4+ e CH3COO-, sono tenuti insieme dalla loro attrazione elettrostatica che, insieme alle repulsioni tra cariche uguali, finiscono per definire un cristallo. Questo cristallo di acetato di ammonio ha una struttura ortorombica, che potrebbe essere osservata in campioni microscopici o anche di dimensioni visibili..
Non solo il legame ionico è importante per questo sale, ma lo sono anche i legami idrogeno. NH4+ puoi donare fino a quattro di questi ponti; cioè, in ciascuno dei vertici del suo tetraedro c'è un atomo di ossigeno da un CH3COO- prossimo (H3N+-H- OCOCH3).
In teoria, le forze all'interno dei tuoi cristalli dovrebbero essere molto forti; ma sperimentalmente accade il contrario, poiché fonde solo a 114 ° C. Pertanto, i legami idrogeno non compensano il debole legame ionico, né la bassa energia reticolare del cristallo ortorombico NH.4CH3COO.
Altre composizioni e acqua
Originariamente si diceva che l'acetato di ammonio fosse preparato mescolando acido acetico e ammoniaca. Pertanto, il sale può anche essere espresso come: NH3CH3COOH. Quindi, a seconda della composizione, si possono ottenere altre strutture: NH32CH3COOH o NH35CH3COOH, per esempio.
Inoltre, è stato detto che assorbe un bel po 'di umidità. In tal modo, incorpora molecole d'acqua nei suoi cristalli, che idrolizzano per dare NH3 o CH3COOH; ed è per questo che il sale emette odore di ammoniaca o aceto.
Proprietà
Aspetto fisico
Cristalli bianchi deliquescenti con odore di aceto e ammoniaca.
Massa molare
77,083 g / mol.
Densità
1.073 g / mL a 25ºC.
Punto di fusione
114 ° C. Questo valore è notevolmente inferiore rispetto ad altri sali o composti ionici. Inoltre, manca un punto di ebollizione a causa della formazione di ammoniaca, il che implica la decomposizione del sale..
Solubilità
143 g / 100 mL a 20 ° C. Da notare la sua straordinaria solubilità in acqua, che mostra l'affinità provata dalle molecole d'acqua per gli ioni NH.4+ e CH3COO-, idratandoli in sfere acquose.
La sua solubilità non è tale in solventi meno polari. Ad esempio, in 100 mL di metanolo a 15ºC, vengono sciolti 7,89 g di NH4CH3COO.
Stabilità
È deliquescente, quindi dovresti evitare di riporlo in spazi umidi. Inoltre, mentre assorbe l'acqua, rilascia ammoniaca e quindi si decompone.
pKa
9.9.
Questa costante corrisponde all'acidità dello ione ammonio:
NH4+ + B <=> NH3 + HB
Dove HB è un acido debole. Se la base B riguarda l'acqua, avrà la sua reazione di idrolisi:
NH4+ + HDueO <=> NH3 + H3O+
In cui la specie H3O+ definisce il pH della soluzione.
D'altra parte, anche l'acetato contribuisce al pH:
CH3COO- + HDueO <=> CH3COOH + OH-
Quindi entrambe le specie H3O+ e OH- vengono neutralizzati dando un pH neutro 7. Tuttavia, secondo Pubchem, le soluzioni di acetato di ammonio altamente concentrate hanno un pH acido; il che significa che predomina l'idrolisi dell'NH4+ sulla CH3COO-.
Entalpia di formazione standard
ΔFH298 = -615 kJ / mol.
Applicazioni
Analitico
Soluzioni acquose di acetato di sodio consentono di solubilizzare solfati di piombo, ferro e zinco, per determinarne successivamente la concentrazione mediante spettroscopia di assorbimento atomico.
Conduttore medio
Poiché fonde a bassa temperatura rispetto ad altri sali, il suo liquido può essere utilizzato per condurre la corrente elettrica che accende il circuito di una lampadina..
Buffer
Può regolare le variazioni di pH in intervalli acidi o basici, che viene utilizzato per mantenere un pH costante, ad esempio, in carni, cioccolatini, formaggi, verdure o altri prodotti alimentari.
Su ghiaccio e suolo
È un sale relativamente economico e biodegradabile, utilizzato per scongelare le strade ghiacciate. Allo stesso modo, poiché è una fonte di azoto idrosolubile, viene utilizzato per scopi agricoli per determinare i livelli di potassio..
Agente precipitante
Questo sale viene utilizzato per precipitare le proteine per l'analisi cromatografica..
Medicinale
L'acetato di ammonio funziona come agente diuretico in medicina veterinaria ed è anche un sale necessario per la sintesi di insulina e penicillina.
Rischi
Di seguito e infine, vengono elencati alcuni rischi o conseguenze negative causati dall'acetato di ammonio:
- Può causare una leggera irritazione alla pelle, ma non viene assorbito.
- Se ingerito provoca disturbi allo stomaco, diarrea, diuresi, ansia, aumento della necessità di urinare, tremori e altri sintomi legati all'avvelenamento da ammoniaca, nonché danni al fegato.
- L'inalazione irrita il naso, la gola e i polmoni.
Per il resto, non è noto se possa provocare il cancro, ed è escluso ogni possibile rischio di incendio da questo sale (almeno in normali condizioni di conservazione)..
Riferimenti
- Inger Nahringbauer. (1967). Studi sui legami idrogeno. XIV. La struttura cristallina dell'acetato di ammonio. Istituto di Chimica, Università di Uppsala, Uppsala, Svezia. Acta Cryst. 23, 956.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acetato di ammonio. Database PubChem. CID = 517165. Estratto da: pubchem.ncbi.nlm.nih.gov
- Sullivan Randy. (2012). Conducibilità dell'acetato di ammonio. Estratto da: chemdemos.uoregon.edu
- Viachem, Ltd. (s.f.). Acetato di ammonio. Estratto da: viacheminc.com
- Wikipedia. (2019). Acetato di ammonio. Estratto da: en.wikipedia.org
- Dipartimento della Salute del New Jersey. (2012). Acetato di ammonio - Scheda informativa sulle sostanze pericolose. [PDF]. Estratto da: nj.gov
- Xueyanghu. (s.f.). Usi e rischi dell'acetato di ammonio. Estratto da: xueyanghu.wordpress.com



Nessun utente ha ancora commentato questo articolo.