
Struttura, proprietà e usi dell'ossido d'argento (Ag2O)
Il ossido d'argento è un composto inorganico la cui formula chimica è AgDueO. La forza che lega i suoi atomi è interamente di natura ionica; pertanto, è costituito da un solido ionico in cui è presente una proporzione di due cationi Ag+ interagendo elettrostaticamente con un anione ODue-.
L'ossido di anione, ODue-, Risulta dall'interazione degli atomi d'argento sulla superficie con l'ossigeno nell'ambiente. più o meno allo stesso modo del ferro e di molti altri metalli. Invece di arrossarsi e sgretolarsi in ruggine, un pezzo o un gioiello d'argento diventa nero, caratteristica dell'ossido d'argento..

Ad esempio, nell'immagine sopra puoi vedere una coppa d'argento ossidata. Notare la sua superficie annerita, sebbene conservi ancora una certa lucentezza ornamentale; ecco perché anche gli oggetti in argento ossidato possono essere considerati abbastanza attraenti per usi decorativi.
Le proprietà dell'ossido d'argento sono tali che, a prima vista, non intaccano la superficie metallica originale. Si forma a temperatura ambiente per semplice contatto con l'ossigeno presente nell'aria; e ancora più interessante, può decomporsi ad alte temperature (superiori a 200 ° C).
Ciò significa che se il vetro nella foto fosse afferrato e gli venisse applicato il calore di una fiamma intensa, riacquisterebbe i suoi bagliori argentati. Pertanto, la sua formazione è un processo termodinamicamente reversibile..
L'ossido d'argento ha anche altre proprietà e, oltre alla sua semplice formula AgDueOppure comprende organizzazioni strutturali complesse e una ricca varietà di solidi. Tuttavia, l'AgDueO forse è accanto all'AgDueO3, il più rappresentativo degli ossidi d'argento.
Indice articolo
- 1 Struttura dell'ossido d'argento
- 1.1 Cambiamenti con il numero di valenza
- 2 Proprietà fisiche e chimiche
- 2.1 Peso molecolare
- 2.2 Aspetto
- 2.3 Densità
- 2.4 Punto di fusione
- 2,5 Kps
- 2.6 Solubilità
- 2.7 Carattere covalente
- 2.8 Decomposizione
- 3 Nomenclatura
- 3.1 Valencia I e III
- 3.2 Nomenclatura sistematica per ossidi d'argento complessi
- 4 Usi
- 5 Riferimenti
Struttura dell'ossido d'argento
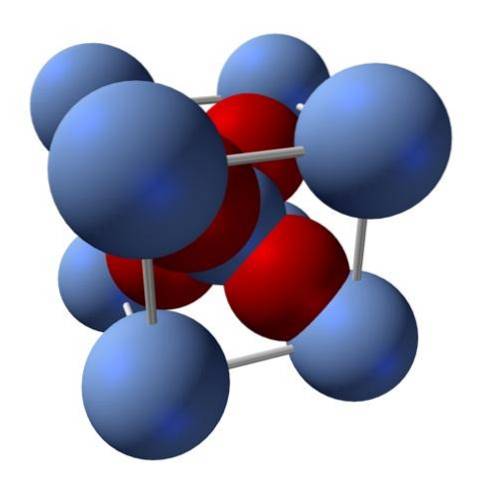
Com'è la sua struttura? Come accennato all'inizio: è un solido ionico. Per questo motivo, non possono esserci né legami covalenti Ag - O né Ag = O nella sua struttura; poiché, se ce ne fossero, le proprietà di questo ossido cambierebbero drasticamente. È quindi ioni Ag+ meDue- in un rapporto 2: 1 e sperimentando attrazione elettrostatica.
La struttura dell'ossido d'argento è quindi determinata dal modo in cui le forze ioniche organizzano gli ioni Ag nello spazio.+ meDue-.
Nell'immagine sopra, ad esempio, c'è una cella unitaria per un sistema cristallino cubico: i cationi Ag+ sono le sfere blu-argento e la ODue- le sfere rossastre.
Se si conta il numero di sfere, si troverà che ci sono, ad occhio nudo, nove blu argentee e quattro rosse. Tuttavia, vengono considerati solo i frammenti delle sfere contenute nel cubo; contando questi, essendo frazioni delle sfere totali, si deve soddisfare il rapporto 2: 1 per AgDueO.
Ripetendo l'unità strutturale del tetraedro AgO4 circondato da altri quattro Ag+, viene costruito l'intero solido nero (evitando le lacune o le irregolarità che possono avere queste disposizioni cristalline).
Cambia con il numero di valenza
Concentrandosi ora non sul tetraedro AgO4 ma sulla linea AgOAg (osservare i vertici del cubo superiore), si vedrà che il solido di ossido d'argento è costituito, da un'altra prospettiva, da più strati di ioni disposti linearmente (sebbene inclinati). Tutto questo come risultato della geometria "molecolare" attorno ad Ag+.
Ciò è stato confermato da diversi studi sulla sua struttura ionica..
L'argento funziona prevalentemente con valenza +1, poiché quando si perde un elettrone la sua configurazione elettronica risultante è [Kr] 4d10, che è molto stabile. Altre valenze, come AgDue+ e Ag3+ sono meno stabili poiché perdono elettroni da orbitali quasi pieni.
L'Ag ion3+, tuttavia, è relativamente meno instabile rispetto all'AgDue+. Può infatti coesistere in compagnia dell'Ag+ arricchendo chimicamente la struttura.
La sua configurazione elettronica è [Kr] 4d8, con elettroni spaiati in modo tale da conferirgli una certa stabilità.
A differenza delle geometrie lineari attorno agli ioni Ag+, è stato riscontrato che quello degli ioni Ag3+ è un piano quadrato. Quindi, un ossido d'argento con ioni Ag3+ consisterebbe in strati composti da quadrati di AgO4 (non tetraedri) collegati elettrostaticamente da linee AgOAg; tale è il caso di Ag4O4 o AgDueO ∙ AgDueO3 con struttura monoclina.
Proprietà fisiche e chimiche

Raschiando la superficie della coppa d'argento nell'immagine principale si otterrebbe un solido, che non è solo di colore nero, ma ha anche sfumature di marrone o marrone (immagine in alto). Alcune delle sue proprietà fisiche e chimiche riportate al momento sono le seguenti:
Peso molecolare
231,735 g / mol
Aspetto
Solido bruno-nero in polvere (si noti che nonostante sia un solido ionico, manca di un aspetto cristallino). È inodore e mescolato con acqua gli conferisce un sapore metallico
Densità
7,14 g / mL.
Punto di fusione
277-300 ° C. Certamente si scioglie in argento massiccio; cioè, probabilmente si decompone prima di formare l'ossido liquido.
Kps
1,52 ∙ 10-8 in acqua a 20 ° C. Si tratta quindi di un composto difficilmente solubile in acqua.
Solubilità
Se guardi da vicino l'immagine della sua struttura scoprirai che le sfere di AgDue+ meDue- non differiscono quasi per dimensioni. Ciò fa sì che solo piccole molecole possano passare attraverso l'interno del reticolo cristallino, rendendolo insolubile in quasi tutti i solventi; tranne quelli in cui reagisce, come basi e acidi.
Carattere covalente
Sebbene sia stato ripetutamente affermato che l'ossido d'argento è un composto ionico, alcune proprietà, come il suo basso punto di fusione, contraddicono questa affermazione..
Certamente, la considerazione del carattere covalente non distrugge quanto è stato spiegato per la sua struttura, poiché basterebbe aggiungere nella struttura di AgDueO un modello di sfere e barre per indicare i legami covalenti.
Allo stesso modo, i tetraedri e i piani quadrati AgO4, così come le linee AgOAg, sarebbero collegate da legami covalenti (o covalenti ionici).
Con questo in mente, l'AgDueOppure sarebbe effettivamente un polimero. Tuttavia, si consiglia di considerarlo come un solido ionico con carattere covalente (la cui natura del legame è ancora oggi una sfida).
Decomposizione
In un primo momento è stato detto che la sua formazione è termodinamicamente reversibile, quindi assorbe il calore per tornare al suo stato metallico. Tutto ciò può essere espresso da due equazioni chimiche per tali reazioni:
4 Ag (s) + ODue(g) => 2AgDueO (s) + Q
2AgDueO (s) + Q => 4Ag (s) + ODue(g)
Dove Q rappresenta il calore nell'equazione. Questo spiega perché il fuoco che brucia la superficie della coppa d'argento ossidata la restituisce al suo bagliore argenteo..
Pertanto, è difficile presumere che ci sia AgDueO (l) poiché si decomporrebbe istantaneamente a causa del calore; A meno che la pressione non venga aumentata troppo per ottenere detto liquido nero bruno.
Nomenclatura
Quando è stata introdotta la possibilità di ioni AgDue+ e Ag3+ oltre al comune e predominante Ag+, il termine "ossido d'argento" comincia a sembrare insufficiente per riferirsi ad AgDueO.
Questo perché lo ione Ag+ è più abbondante degli altri, quindi si prende l'AgDueO come l'unico ossido; che non è affatto corretto.
Se AgDue+ essendo praticamente inesistente data la sua instabilità, avremo solo gli ioni con valenze +1 e +3; cioè Ag (I) e Ag (III).
Valencia I e III
Poiché Ag (I) è quello con la valenza più bassa, viene chiamato aggiungendo il suffisso -oso al suo nome argentum. Così l'AgDueO è: ossido d'argento o, secondo la nomenclatura sistematica, monossido diplato.
Se Ag (III) è completamente ignorato, la sua nomenclatura tradizionale dovrebbe essere: ossido d'argento invece di ossido d'argento.
D'altra parte, essendo Ag (III) la valenza più alta, al suo nome viene aggiunto il suffisso -ico. Così l'AgDueO3 è: ossido di argento (2 ioni Ag3+ con tre ODue-). Inoltre, il suo nome secondo la nomenclatura sistematica sarebbe: diplata triossido.
Se la struttura di AgDueO3, si può presumere che sia il prodotto dell'ossidazione da ozono, OR3, invece dell'ossigeno. Pertanto, il suo carattere covalente deve essere maggiore in quanto è un composto covalente con legami Ag-O-O-O-Ag o Ag-O.3-Ag.
Nomenclatura sistematica per ossidi d'argento complessi
L'AgO, scritto anche come Ag4O4 o AgDueO ∙ AgDueO3, È un ossido d'argento (I, III), poiché ha valenze +1 e +3. Il suo nome secondo la nomenclatura sistematica sarebbe: tetra silver tetraoxide.
Questa nomenclatura è di grande aiuto quando si tratta di altri ossidi d'argento stechiometricamente complessi. Ad esempio, supponiamo che i due solidi 2AgDueO ∙ AgDueO3 e AgDueO ∙ 3AgDueO3.
Scrivere il primo in modo più appropriato sarebbe: Ag6O5 (contando e aggiungendo gli atomi di Ag e O). Il suo nome sarebbe quindi pentossido esaplato. Si noti che questo ossido ha una composizione d'argento meno ricca di AgDueOppure (6: 5 < 2:1).
Scrivendo il secondo solido in un altro modo, sarebbe: Ag8O10. Il suo nome sarebbe decaossido di octa-argento (con un rapporto 8:10 o 4: 5). Questo ipotetico ossido d'argento sarebbe "molto ossidato".
Applicazioni
Gli studi alla ricerca di nuovi e sofisticati usi dell'ossido d'argento continuano ancora oggi. Alcuni dei suoi usi sono elencati di seguito:
-Si dissolve in ammoniaca, nitrato di ammonio e acqua per formare il reagente Tollens. Questo reagente è uno strumento utile nell'analisi qualitativa all'interno dei laboratori di chimica organica. Permette di determinare la presenza di aldeidi in un campione, con la formazione di uno "specchio d'argento" nella provetta come risposta positiva..
-Insieme allo zinco metallico, forma le batterie primarie all'ossido di zinco-argento. Questo è forse uno dei suoi usi più comuni e domestici.
-Serve come purificatore di gas, assorbendo ad esempio CODue. Quando riscaldato, rilascia gas intrappolati e può essere riutilizzato più volte.
-A causa delle proprietà antimicrobiche dell'argento, il suo ossido è utile negli studi di bioanalisi e purificazione del suolo..
-È un blando agente ossidante in grado di ossidare le aldeidi in acidi carbossilici. Viene anche utilizzato nella reazione di Hofmann (delle ammine terziarie) e partecipa ad altre reazioni organiche, sia come reagente che come catalizzatore..
Riferimenti
- Bergstresser M. (2018). Ossido d'argento: formula, decomposizione e formazione. Studia. Estratto da: study.com
- Autori e curatori dei volumi III / 17E-17F-41C. (s.f.). Ossidi d'argento (Ag (x) O (y)) struttura cristallina, parametri reticolari. (Dati numerici e relazioni funzionali nella scienza e nella tecnologia), vol 41C. Springer, Berlino, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Il potenziale impatto del trattamento energetico Biofield sulle proprietà fisiche e termiche della polvere di ossido di argento. Giornale internazionale di scienza e ingegneria biomedica. Vol.3, No.5, pagg. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Decomposizione dell'ossido d'argento. Università dell'Oregon. Estratto da: chemdemos.uoregon.edu
- Flint, Deyanda. (24 aprile 2014). Usi delle batterie all'ossido di argento. Scienza. Estratto da: sciencing.com
- Salman Montasir E. (2016). Studio di alcune proprietà ottiche dell'ossido d'argento (Ag2o) utilizzando lo spettrofotometro UVVisible. [PDF]. Estratto da: iosrjournals.org
- Bard Allen J. (1985). Potenziali standard in soluzione acquosa. Marcel Dekker. Estratto da: books.google.co.ve


Nessun utente ha ancora commentato questo articolo.