
Struttura, proprietà, sintesi dell'acetanilide (C8H9NO)
Il acetanilide (C8H9NO) è un'ammide aromatica che riceve diversi nomi aggiuntivi: N-acetylarylamine, N-phenylacetamide e acetanil. Si presenta come un solido inodore sotto forma di fiocchi, la sua natura chimica è ammide e come tale può formare gas infiammabili quando reagisce con forti agenti riducenti..
Inoltre, è una base debole, essendo in grado di reagire con agenti disidratanti come PDueO5 dare origine a un nitrile. Si scoprì che l'acetanilide aveva un'azione analgesica e antipiretica e fu usata nel 1886 con il nome di Antifebrina da A. Cahn e P. Hepp..

Nel 1899 fu introdotto sul mercato l'acido acetilsalicilico (aspirina), che aveva le stesse azioni terapeutiche dell'acetanilide. Poiché l'uso di acetanilide era correlato alla comparsa di cianosi nei pazienti - una conseguenza della metaemoglobinemia indotta da acetanilide - il suo uso è stato escluso..
Successivamente, è stato accertato che l'azione analgesica e antipiretica dell'acetanilide risiedeva in un suo metabolita chiamato paracetamolo (acetoaminofene), che non aveva i suoi effetti tossici, come suggerito da Axelrod e Brodie..
Indice articolo
- 1 Struttura chimica
- 1.1 Strutture di risonanza e interazioni intermolecolari
- 2 Proprietà chimiche
- 2.1 Peso molecolare
- 2.2 Descrizione chimica
- 2.3 Odore
- 2.4 Aroma
- 2.5 Punto di ebollizione
- 2.6 Punto di fusione
- 2.7 Punto di infiammabilità o punto di infiammabilità
- 2.8 Densità
- 2.9 Densità del vapore
- 2.10 Pressione di vapore
- 2.11 Stabilità
- 2.12 Volatilità
- 2.13 Autoaccensione
- 2.14 Decomposizione
- 2,15 pH
- 2.16 Solubilità
- 3 Sintesi
- 4 Applicazioni
- 5 Riferimenti
Struttura chimica
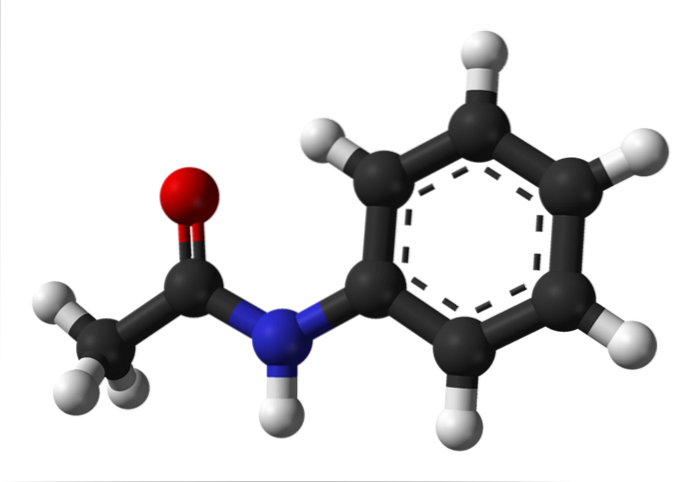
L'immagine in alto rappresenta la struttura chimica dell'acetanilide. A destra c'è l'anello esagonale aromatico del benzene (con linee tratteggiate), ea sinistra è il motivo per cui il composto è costituito da un'ammide aromatica: il gruppo acetamido (HNCOCH3).
Il gruppo acetammido conferisce all'anello benzenico un carattere polare maggiore; cioè, crea un momento di dipolo nella molecola di acetanilide.
Perché? Perché l'azoto è più elettronegativo di qualsiasi atomo di carbonio nell'anello ed è anche legato al gruppo acile, il cui atomo di O attrae anche la densità elettronica.
D'altra parte, quasi l'intera struttura molecolare dell'acetanilide poggia sullo stesso piano a causa dell'ibridazione spDue degli atomi che lo compongono.
C'è un'eccezione legata a quelle del gruppo -CH3, i cui atomi di idrogeno costituiscono i vertici di un tetraedro (le sfere bianche all'estrema sinistra escono dal piano).
Strutture di risonanza e interazioni intermolecolari
La coppia solitaria senza condividere l'atomo di N circola attraverso il sistema π dell'anello aromatico, originando diverse strutture di risonanza. Tuttavia, una di queste strutture finisce con una carica negativa sull'atomo di O (più elettronegativa) e una carica positiva sull'atomo di azoto..
Quindi, ci sono strutture di risonanza in cui una carica negativa si muove nell'anello e un'altra dove risiede nell'atomo di O. Come conseguenza di questa "asimmetria elettronica" -che va di pari passo con l'asimmetria molecolare-, l'acetanilide interagisce in modo intermolecolare per dipolo -forze dipolari.
Tuttavia, le interazioni di legame idrogeno (N-H-O-…) tra due molecole di acetanilide sono, infatti, la forza predominante nella loro struttura cristallina..
Pertanto, i cristalli di acetanilide sono costituiti da cellule unitarie ortorombiche di otto molecole orientate in forme "a nastro piatto" dai loro legami idrogeno..
Questo può essere visualizzato posizionando una molecola di acetanilide sopra l'altra, in parallelo. Quindi, come i gruppi HNCOCH3 si sovrappongono spazialmente, formano legami idrogeno.
Inoltre, tra queste due molecole una terza può anche "scivolare", ma con il suo anello aromatico rivolto verso il lato opposto..
Proprietà chimiche
Peso molecolare
135,166 g / mol.
Descrizione chimica
Bianco fisso o bianco sporco. Forma scaglie bianche lucide o una polvere cristallina bianca.
Odore
Gabinetto.
Gusto
Leggermente piccante.
Punto di ebollizione
Da 304 ° C a 760 mmHg (da 579 ° F a 760 mmHg).
Punto di fusione
114,3 ° C (237,7 ° F).
Punto di infiammabilità o punto di infiammabilità
169 ° C (337 ° F). Misura eseguita in vetro aperto.
Densità
1.219 mg / mL a 15ºC (1.219 mg / mL a 59ºF)
Densità del vapore
4,65 rispetto all'aria.
Pressione del vapore
1 mmHg a 237ºF, 1.22 × 10-3 mmHg a 25ºC, 2Pa a 20ºC.
Stabilità
Subisce un riarrangiamento chimico quando esposto alla luce UV. Come cambia la struttura? Il gruppo acetile forma nuovi legami sull'anello nelle posizioni orto e para. Inoltre, è stabile all'aria e incompatibile con forti agenti ossidanti, caustici e alcali..
Volatilità
Apprezzabilmente volatile a 95 ºC.
Autoaccensione
1004ºF.
Decomposizione
Si decompone se riscaldato emettendo un fumo altamente tossico.
pH
5-7 (10 g / L di H.DueOppure a 25 ºC)
Solubilità
- In acqua: 6,93 × 103 mg / mL a 25 ºC.
- Solubilità di 1 g di acetanilide in diversi liquidi: in 3,4 ml di alcool, 20 ml di acqua bollente, 3 ml di metanolo, 4 ml di acetone, 0,6 ml di alcol bollente, 3,7 ml di cloroformio, 5 ml di gliecerol, 8 ml di diossano, 47 ml di benzene e 18 ml di etere. L'idrato di cloralio aumenta la solubilità dell'acetanilide in acqua.
Sintesi
Viene sintetizzato facendo reagire l'anidride acetica con l'acetanilide. Questa reazione appare in molti testi di Chimica Organica (Vogel, 1959):
C6H5NHDue + (CH3CO)DueO => C6H5NHCOCH3 + CH3COOH
Applicazioni
-È un agente inibitore del processo di decomposizione del perossido di idrogeno (perossido di idrogeno).
-Stabilizza le vernici a base di esteri di cellulosa.
-Interviene come intermediario nell'accelerazione della produzione della gomma. Allo stesso modo, è un intermediario nella sintesi di alcuni coloranti e canfora..
-Agisce come un precursore nella sintesi della penicillina.
-È utilizzato nella produzione di 4-acetamidosulfonilbenzene cloruro. L'acetanilide reagisce con l'acido clorosolfonico (HSO3Cl), producendo così 4-aminosulfonilbenzene cloruro. Questo reagisce con l'ammoniaca o un'ammina organica primaria per formare sulfonamidi..
-È stato utilizzato sperimentalmente nel 19 ° secolo nello sviluppo della fotografia.
-L'acetanilide viene utilizzata come marker dei flussi elettroosmotici (EOF) nell'elettroforesi capillare per lo studio del legame tra farmaci e proteine..
-Recentemente (2016) l'acetanilide è stata collegata all'1- (ω-fenossialchiluracile) in esperimenti per inibire la replicazione del virus dell'epatite C. L'acetanilide si lega alla posizione 3 dell'anello pirimidinico.
-I risultati sperimentali indicano una riduzione della replicazione del genoma virale, indipendentemente dal genotipo virale..
-Prima che la tossicità dell'acetanilide fosse identificata, era usata come analgesico e antipiretico dal 1886. Successivamente (1891), fu usata nel trattamento della bronchite cronica e acuta da Grün.
Riferimenti
- J. Brown e D.E.C. Corbridge. (1948). Struttura cristallina dell'acetanilide: uso della radiazione infrarossa polarizzata. Nature volume 162, pagina 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) L'uso di acetanilide nel trattamento della bronchite acuta e cronica. Lancet 137 (3539): 1424-1426.
- Magri, A. et al. (2016). Esplorazione dei derivati dell'acetanilide di 1- (ω-fenossialchil) uracili come nuovi inibitori della replicazione del virus dell'epatite C. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilide. Estratto il 5 giugno 2018 da: sigmaaldrich.com
- Rapporto di valutazione iniziale SIDS per 13th SIAM. Acetanilide. [PDF]. Estratto il 5 giugno 2018 da: inchem.org
- Wikipedia. (2018). Acetanilide. Estratto il 5 giugno 2018 da: en.wikipedia.org
- PubChem. (2018). Acetanilide. Estratto il 5 giugno 2018 da: pubchem.ncbi.nlm.nih.gov



Nessun utente ha ancora commentato questo articolo.