
Struttura, proprietà e usi dell'ossido di oro (III) (Au2O3)
Il ossido di oro (III) è un composto inorganico la cui formula chimica è AuDueO3. In teoria, ci si potrebbe aspettare che la sua natura sia di tipo covalente. Tuttavia, la presenza di un certo carattere ionico nel suo solido non può essere completamente esclusa; o cosa è lo stesso, supponi l'assenza dell'Autorizzazione3+ accanto all'anione ODue-.
Può sembrare contraddittorio che l'oro, essendo un metallo nobile, possa arrugginire. In condizioni normali, i pezzi d'oro (come le stelle nell'immagine sotto) non possono essere ossidati dal contatto con l'ossigeno nell'atmosfera; tuttavia, se irradiato con radiazioni ultraviolette in presenza di ozono, OPPURE3, il panorama è diverso.

Se le stelle d'oro fossero sottoposte a queste condizioni, assumerebbero un colore bruno-rossastro, caratteristico dell'AuDueO3.
Altri metodi per ottenere questo ossido implicherebbero il trattamento chimico di dette stelle; per esempio, convertendo la massa dell'oro nel suo rispettivo cloruro, AuCl3.
Poi ad AuCl3, e il resto dei possibili sali d'oro formati, viene aggiunto un mezzo di base forte; e con questo si ottiene l'ossido o idrossido idrato, Au (OH)3. Infine, quest'ultimo composto viene disidratato termicamente per ottenere AuDueO3.
Indice articolo
- 1 Struttura dell'ossido d'oro (III)
- 1.1 Aspetti elettronici
- 1.2 Idrata
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molecolare
- 2.3 Densità
- 2.4 Punto di fusione
- 2.5 Stabilità
- 2.6 Solubilità
- 3 Nomenclatura
- 4 Usi
- 4.1 Colorazione del vetro
- 4.2 Sintesi di aurati e oro fulminante
- 4.3 Manipolazione di monostrati autoassemblati
- 5 Riferimenti
Struttura dell'ossido d'oro (III)
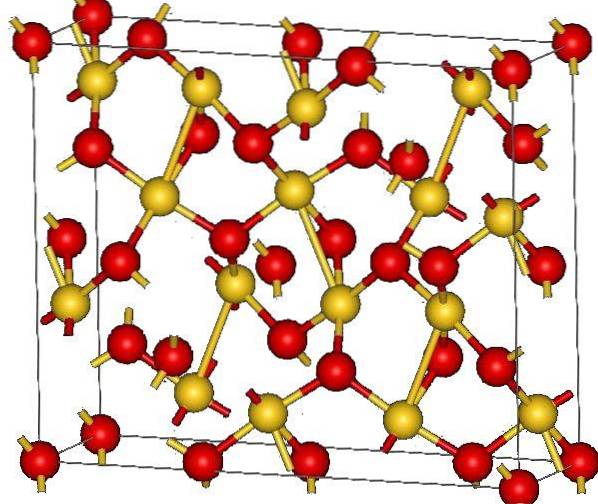
L'immagine in alto mostra la struttura cristallina dell'ossido d'oro (III). Viene mostrata la disposizione degli atomi di oro e ossigeno nel solido, considerandoli atomi neutri (solido covalente) o ioni (solido ionico). Indifferentemente, è sufficiente rimuovere o posizionare in ogni caso i collegamenti Au-O.
Secondo l'immagine, si presume che predomina il carattere covalente (il che sarebbe logico). Per questo motivo, vengono mostrati gli atomi e i legami rappresentati rispettivamente con sfere e barre. Le sfere d'oro corrispondono agli atomi d'oro (AuIII-O), e quelli rossastri agli atomi di ossigeno.
Se guardi da vicino vedrai che ci sono unità AuO4, che sono uniti da atomi di ossigeno. Un altro modo per visualizzarlo sarebbe considerare che ogni Au3+ è circondato da quattro ODue-; ovviamente, da una prospettiva ionica.
Questa struttura è cristallina perché gli atomi sono disposti obbedendo allo stesso schema a lungo raggio. Pertanto, la sua cella unitaria corrisponde al sistema cristallino romboedrico (lo stesso nell'immagine in alto). Pertanto, tutti gli AuDueO3 potrebbe essere costruito se tutte quelle sfere della cella unitaria fossero distribuite nello spazio.
Aspetti elettronici
L'oro è un metallo di transizione e si prevede che i suoi orbitali 5d interagiscano direttamente con gli orbitali 2p dell'atomo di ossigeno. Questa sovrapposizione dei loro orbitali dovrebbe teoricamente generare bande di conduzione, che convertiranno AuDueO3 in un solido semiconduttore.
Pertanto, la vera struttura di AuDueO3 è ancora più complesso con questo in mente.
Idrata
L'ossido d'oro può trattenere le molecole d'acqua all'interno dei suoi cristalli romboedrici, dando origine agli idrati. Quando si formano tali idrati, la struttura diventa amorfa, cioè disordinata.
La formula chimica di tali idrati può essere una delle seguenti, che in realtà non sono completamente chiarite: AuDueO3∙ zHDueO (z = 1, 2, 3, ecc.), Au (OH)3, o AuXOY(OH)z.
La formula Au (OH)3 rappresenta una semplificazione eccessiva della reale composizione di detti idrati. Questo perché all'interno dell'idrossido d'oro (III), i ricercatori hanno anche scoperto la presenza di AuDueO3; e quindi, non ha senso trattarlo isolatamente come un "semplice" idrossido di metallo di transizione.
D'altra parte, da un solido con formula AuXOY(OH)z ci si poteva aspettare una struttura amorfa; poiché dipende dai coefficienti X, Y Y z, le cui variazioni darebbero origine a tutti i tipi di struttura che difficilmente potrebbero esibire un modello cristallino.
Proprietà
Aspetto fisico
È un solido marrone rossastro.
Massa molecolare
441,93 g / mol.
Densità
11,34 g / mL.
Punto di fusione
Si scioglie e si decompone a 160ºC. Pertanto, manca un punto di ebollizione, quindi questo ossido non raggiunge mai l'ebollizione..
Stabilità
AUDueO3 è termodinamicamente instabile perché, come accennato all'inizio, l'oro non tende ad ossidarsi in condizioni di temperatura normale. Quindi è facilmente ridotto per diventare di nuovo l'oro nobile.
Maggiore è la temperatura, più veloce è la reazione, nota come decomposizione termica. Pertanto, l'AuDueO3 a 160 ° C si decompone per produrre oro metallico e rilasciare ossigeno molecolare:
2 AuDueO3 => 4 Au + 3 ODue
Una reazione molto simile può verificarsi con altri composti che promuovono detta riduzione. Perché la riduzione? Perché l'oro riguadagna gli elettroni che l'ossigeno gli ha preso; il che equivale a dire che perde legami con l'ossigeno.
Solubilità
È un solido insolubile in acqua. Tuttavia, è solubile in acido cloridrico e acido nitrico, a causa della formazione di cloruri d'oro e nitrati..
Nomenclatura
L'ossido di oro (III) è il nome regolato dalla nomenclatura azionaria. Altri modi per menzionarlo sono:
-Nomenclatura tradizionale: ossido aurico, perché la valenza 3+ è la più alta per l'oro.
-Nomenclatura sistematica: dioro triossido.
Applicazioni
Colorazione del vetro
Uno dei suoi usi più eminenti è quello di aggiungere un colore rossastro a determinati materiali, come il vetro, oltre a conferire alcune proprietà inerenti agli atomi d'oro..
Sintesi di aurati e oro fulminante
Se viene aggiunto AuDueO3 in un mezzo dove è solubile e in presenza di metalli, gli aurati possono precipitare dopo l'aggiunta di una base forte; che sono formati da anioni AuO4- in compagnia di cationi metallici.
Inoltre, l'AuDueO3 reagisce con l'ammoniaca per formare il composto d'oro fulminante, AuDueO3(NH3)4. Il suo nome deriva dal fatto che è altamente esplosivo.
Movimentazione monostrati autoassemblati
Alcuni composti, come dialchil disolfuro, RSSR, non vengono adsorbiti allo stesso modo sull'oro e sul suo ossido. Quando avviene questo adsorbimento, si forma spontaneamente un legame Au-S, dove l'atomo di zolfo esibisce e definisce le caratteristiche chimiche di detta superficie a seconda del gruppo funzionale a cui è attaccato..
Gli RSSR non possono essere adsorbiti su AuDueO3, ma sì sull'oro metallico. Pertanto, se la superficie dell'oro viene modificata e il suo grado di ossidazione, nonché la dimensione delle particelle o degli strati di AuDueO3, è possibile progettare una superficie più eterogenea.
Questa superficie AuDueO3-AuSR interagisce con gli ossidi metallici di alcuni dispositivi elettronici, sviluppando così superfici future più intelligenti.
Riferimenti
- Wikipedia. (2018). Ossido di oro (III). Estratto da: en.wikipedia.org
- Formulazione chimica. (2018). Ossido di oro (III). Estratto da: formulacionquimica.com
- D. Michaud. (2016, 24 ottobre). Ossidi d'oro. 911 Metallurgist. Estratto da: 911metallurgist.com
- Shi, R. Asahi e C. Stampfl. (2007). Proprietà degli ossidi d'oro AuDueO3 e AuDueOppure: indagine sui primi principi. L'American Physical Society.
- Cook, Kevin M. (2013). Ossido d'oro come strato di mascheramento per la chimica delle superfici regioselettive. Tesi e dissertazioni. Carta 1460.



Nessun utente ha ancora commentato questo articolo.