
Struttura, proprietà, usi, rischi, esplosione del trinitrotoluene (TNT)
Il trinitrotoluene è un composto organico costituito da carbonio, ossigeno, idrogeno e azoto con tre gruppi nitro-NODue. La sua formula chimica è C6HDue(CH3)(NONDue)3 o anche la formula condensata C7H5N3O6.
Il suo nome completo è 2,4,6-trinitrotoluene, ma è comunemente noto come TNT. È un solido cristallino bianco che può esplodere se riscaldato al di sopra di una certa temperatura.

La presenza in trinitrotoluene dei tre gruppi nitro-NODue favorisce il fatto che esploda con una certa facilità. Per questo motivo è stato ampiamente utilizzato in ordigni esplosivi, proiettili, bombe e granate..
È stato utilizzato anche per esplosioni subacquee, in pozzi profondi e per esplosioni industriali o non belliche..
Il TNT è un prodotto delicato che può esplodere anche da colpi molto forti. È anche tossico per l'uomo, gli animali e le piante. I luoghi in cui sono avvenute le loro esplosioni sono stati contaminati e sono in corso indagini per eliminare i resti di questo composto.
Un modo che può essere efficace ed economico per ridurre la concentrazione di TNT nell'ambiente contaminato è attraverso l'uso di alcuni tipi di batteri e funghi..
Indice articolo
- 1 Struttura chimica
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Punto di infiammabilità
- 3.6 Densità
- 3.7 Solubilità
- 3.8 Proprietà chimiche
- 4 Processo di esplosione di TNT
- 4.1 Reazione di ossidazione del TNT
- 5 Ottenere TNT
- 6 Usi di TNT
- 6.1 Nelle attività militari
- 6.2 Nelle applicazioni industriali
- 7 Rischi di TNT
- 8 Inquinamento dell'ambiente con TNT
- 8.1 Soluzione alla contaminazione da TNT
- 8.2 Bonifica con batteri e funghi
- 8.3 Bonifica con alghe
- 9 Riferimenti
Struttura chimica
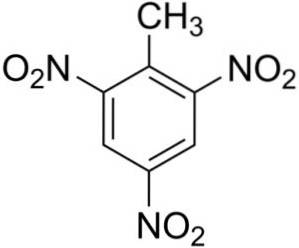
Il 2,4,6-Trinitrotoluene è costituito da una molecola di toluene C.6H5-CH3, a cui sono stati aggiunti tre gruppi nitro -NODue.
I tre gruppi nitro -NODue si trovano simmetricamente sull'anello benzenico del toluene. Si trovano nelle posizioni 2, 4 e 6, dove la posizione 1 corrisponde a metil -CH3.
Nomenclatura
- Trinitrotoluene
- 2,4,6-trinitrotoluene
- TNT
- Trilite
- 2-metil-1,3,5-trinitrobenzene
Proprietà
Stato fisico
Solido cristallino da incolore a giallo pallido. Cristalli a forma di ago.
Peso molecolare
227,13 g / mol.
Punto di fusione
80,5 ºC.
Punto di ebollizione
Non bolle. Si decompone con un'esplosione a 240 ºC.
Punto d'infiammabilità
Non è possibile misurarlo perché esplode.
Densità
1,65 g / cm3
Solubilità
Quasi insolubile in acqua: 115 mg / L a 23 ° C. Molto leggermente solubile in etanolo. Molto solubile in acetone, piridina, benzene e toluene.
Proprietà chimiche
Può decomporsi in modo esplosivo se riscaldato. Al raggiungimento di 240 ° C esplode. Può anche esplodere quando si subiscono colpi molto forti.
Quando riscaldato fino alla decomposizione, produce gas tossici di ossidi di azoto NOX.
Processo di esplosione TNT
L'esplosione di TNT porta a una reazione chimica. Fondamentalmente è un processo di combustione in cui l'energia viene rilasciata molto rapidamente. Inoltre, vengono emessi gas che sono agenti per trasferire energia.

Il combustibile e l'ossidante devono essere presenti affinché abbia luogo una reazione di combustione (ossidazione).
Nel caso del TNT, entrambi sono nella stessa molecola, poiché gli atomi di carbonio (C) e idrogeno (H) sono i combustibili e l'ossidante è l'ossigeno (O) dei gruppi nitro-NO.Due. Ciò consente alla reazione di essere più veloce.
Reazione di ossidazione del TNT
Durante la reazione di combustione del TNT gli atomi si riorganizzano e l'ossigeno (O) rimane più vicino al carbonio (C). Inoltre, l'azoto di -NODue viene ridotto per formare azoto gassoso NDue che è un composto molto più stabile.
La reazione chimica di esplosione del TNT può essere riassunta come segue:
2 C7H5N3O6 → 7 CO ↑ + 7 C + 5 HDueO ↑ + 3 NDue↑
Il carbonio (C) viene prodotto durante l'esplosione, sotto forma di una nuvola nera, e si forma anche monossido di carbonio (CO), perché non c'è abbastanza ossigeno nella molecola per ossidare completamente tutti gli atomi di carbonio (C) e idrogeno (H) presente.
Ottenere TNT
Il TNT è un composto prodotto solo artificialmente dall'uomo.
Non si trova naturalmente nell'ambiente. Si verifica solo in alcune installazioni militari.
È preparato mediante nitrazione del toluene (C.6H5-CH3) con una miscela di acido nitrico HNO3 e acido solforico HDueSW4. Per prima cosa ottieni una miscela di orto- Y in modo da-nitrotolueni che per successiva nitrazione energetica formano il trinitrotoluene simmetrico.
Usi di TNT
Nelle attività militari
Il TNT è un esplosivo che è stato utilizzato in dispositivi bellici ed esplosioni militari.
Viene utilizzato per riempire proiettili, granate e bombe aviotrasportate, poiché è abbastanza insensibile all'impatto ricevuto da lasciare la canna di un'arma, ma può esplodere se colpito da un meccanismo di detonazione.

Non progettato per produrre una frammentazione significativa o lanciare proiettili.
Nelle applicazioni industriali
È stato utilizzato per esplosioni di interesse industriale, esplosioni subacquee (per la sua insolubilità in acqua) ed esplosioni di pozzi profondi. In passato era più spesso utilizzato per le demolizioni. Attualmente è utilizzato insieme ad altri composti.

È stato anche un intermediario per coloranti e prodotti chimici fotografici.
Rischi di TNT
Può esplodere se esposto a calore intenso, fuoco o urti molto forti.
È irritante per gli occhi, la pelle e le vie respiratorie. È un composto molto tossico sia per l'uomo che per gli animali, le piante e molti microrganismi..
I sintomi di esposizione al TNT includono mal di testa, debolezza, anemia, epatite tossica, cianosi, dermatiti, danni al fegato, congiuntivite, scarso appetito, nausea, vomito, diarrea, tra gli altri..
È un mutageno, cioè può modificare l'informazione genetica (DNA) di un organismo provocando cambiamenti che possono essere correlati alla comparsa di malattie ereditarie.
È stato anche classificato come cancerogeno o generatore di cancro.
Inquinamento dell'ambiente con TNT
Il TNT è stato rilevato nel suolo e nelle acque nelle aree di operazioni di guerra militare, nei siti di produzione di munizioni e dove vengono svolte operazioni di addestramento militare..

La contaminazione con TNT è pericolosa per la vita di animali, esseri umani e piante. Sebbene il TNT sia attualmente utilizzato in quantità minori, è uno dei composti nitroaromatici più utilizzati nell'industria degli esplosivi..
Per questo motivo è uno di quelli che contribuisce maggiormente all'inquinamento ambientale..
Soluzione alla contaminazione con TNT
La necessità di "pulire" le regioni contaminate da TNT ha motivato lo sviluppo di diversi processi di bonifica. La bonifica è la rimozione degli inquinanti dall'ambiente.
Bonifica con batteri e funghi
Molti microrganismi sono in grado di medicare il TNT, come i batteri del genere Pseudomonas, Enterobacter, Mycobacterium Y Clostridium.
È stato anche scoperto che ci sono alcuni batteri che si sono evoluti in luoghi contaminati dal TNT e che possono sopravvivere e anche degradarlo o metabolizzarlo come fonte di nutrienti.
Il Escherichia coli Ad esempio, ha mostrato una spiccata capacità di biotrasformazione del TNT, poiché ha più enzimi per attaccarlo, dimostrando allo stesso tempo un'elevata tolleranza alla sua tossicità.
Inoltre, alcune specie di funghi possono biotrasformare il TNT, trasformandolo in minerali non nocivi..
Bonifica alghe
D'altra parte, alcuni ricercatori hanno scoperto che l'alga Spirulina platensis ha la capacità di adsorbire sulla superficie delle cellule e di assimilare fino all'87% del TNT presente nell'acqua contaminata da questo composto.
La tolleranza di questa alga nei confronti del TNT e la sua capacità di pulire l'acqua contaminata da essa indicano l'elevato potenziale di questa alga come fitoremediatore..
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). 2,4,6-trinitrotoluene. Recupero da pubchem.ncbi.nlm.nih.gov.
- Murray, S.G. (2000). Esplosivi. Meccanismo di esplosione. In Encyclopedia of Forensic Sciences 2000, pagine 758-764. Recupero da sciencedirect.com.
- Adamia, G. et al. (2018). Sulla possibilità di applicazione dell'alga Spirulina per il fitorisanamento di acque inquinate con 2,4,6-trinitrotoluene. Annals of Agrarian Science 16 (2018) 348-351. Recuperato da reader.elsevier.com.
- Serrano-González, M.Y. et al. (2018). Biotrasformazione e degradazione del 2,4,6-trinitrotoluene mediante metabolismo microbico e loro interazione. Defense Technology 14 (2018) 151-164. Recuperato da pdf.sciencedirectassets.com.
- Iman, M. et al. (2017). Approccio di biologia dei sistemi al biorisanamento dei nitroaromatici: analisi basata sui vincoli della biotrasformazione del 2,4,6-trinitrotoluene mediante Escherichia coli. Molecole 2017, 22, 1242. Recupero da mdpi.com.
- Windholz, M. et al. (editori) (1983). L'indice Merck. Un'enciclopedia di prodotti chimici, farmaci e biologici. Decima edizione. Merck & CO., Inc.
- Morrison, R.T. e Boyd, R.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.


Nessun utente ha ancora commentato questo articolo.