
Caratteristiche, struttura, ibridazione dell'atomo di carbonio

Il atomo di carbonio è forse il più importante ed emblematico di tutti gli elementi, perché grazie ad esso l'esistenza della vita è possibile. Racchiude in sé non solo pochi elettroni, o un nucleo con protoni e neutroni, ma anche polvere di stelle, che finisce per inglobarsi e forma esseri viventi.
Allo stesso modo, gli atomi di carbonio si trovano nella crosta terrestre, sebbene non in abbondanza paragonabile a elementi metallici come ferro, carbonati, anidride carbonica, petrolio, diamanti, carboidrati, ecc., Fanno parte delle sue manifestazioni fisiche e chimiche.
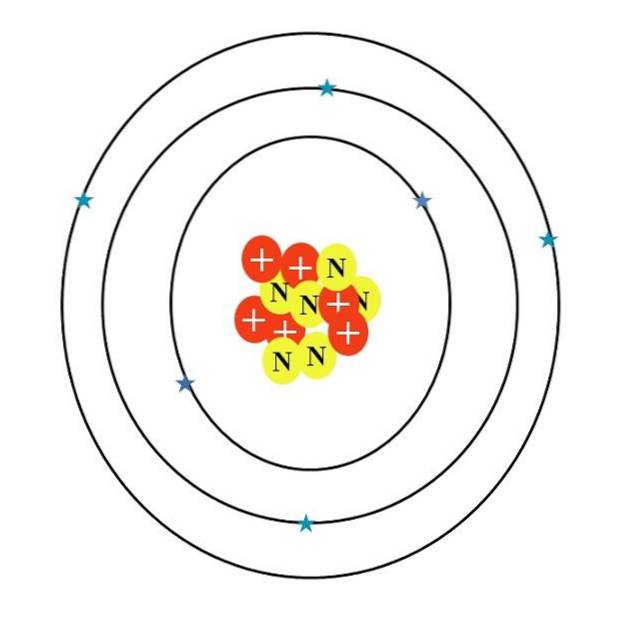
Ma com'è l'atomo di carbonio? Un primo schizzo impreciso è quello visto nell'immagine sopra, le cui caratteristiche sono descritte nella sezione seguente.
Gli atomi di carbonio attraversano l'atmosfera, i mari, il sottosuolo, le piante e qualsiasi specie animale. La sua grande diversità chimica è dovuta all'elevata stabilità dei suoi legami e al modo in cui sono disposti nello spazio. Quindi, da un lato c'è la grafite morbida e lubrificante; e dall'altra il diamante, la cui durezza supera quella di molti materiali.
Se l'atomo di carbonio non avesse le qualità che lo caratterizzano, la chimica organica non esisterebbe completamente. Alcuni visionari vedono in esso i nuovi materiali del futuro, attraverso il design e la funzionalizzazione delle loro strutture allotropiche (nanotubi di carbonio, grafene, fullereni, ecc.).
Indice articolo
- 1 Caratteristiche dell'atomo di carbonio
- 2 Struttura
- 3 Ibridazione
- 3.1 sp3
- 3.2 sp2 e sp
- 4 Classificazione
- 4.1 Primario
- 4.2 Secondario
- 4.3 Terziario
- 4.4 Quaternario
- 5 Usi
- 5.1 Unità di massa atomica
- 5.2 Ciclo e vita del carbonio
- 5.3 Spettroscopia NMR 13C
- 6 Riferimenti
Caratteristiche dell'atomo di carbonio
L'atomo di carbonio è simboleggiato dalla lettera C. Il suo numero atomico Z è 6, quindi ha sei protoni (cerchi rossi con il simbolo "+" nel nucleo). Inoltre, ha sei neutroni (cerchi gialli con la lettera "N") e infine sei elettroni (stelle blu).
La somma delle masse delle sue particelle atomiche dà un valore medio di 12,0107 u. Tuttavia, l'atomo nell'immagine corrisponde all'isotopo del carbonio 12 (12C), che consiste in d. Altri isotopi, come 13C e 14C, meno abbondante, varia solo nel numero di neutroni.
Quindi, se questi isotopi sono stati disegnati, il file 13C avrebbe un ulteriore cerchio giallo e il 14C, altri due. Ciò significa logicamente che sono atomi di carbonio più pesanti..
Oltre a questo, quali altre caratteristiche si possono citare a riguardo? È tetravalente, cioè può formare quattro legami covalenti. Si trova nel gruppo 14 (IVA) della tavola periodica, più precisamente nel blocco p.
È anche un atomo molto versatile, capace di legarsi con quasi tutti gli elementi della tavola periodica; soprattutto con se stesso, formando macromolecole e polimeri lineari, ramificati e laminare.
Struttura
Qual è la struttura di un atomo di carbonio? Per rispondere a questa domanda, prima devi andare alla sua configurazione elettronica: 1sDue2sDue2 PDue o [He] 2sDue2 PDue.
Pertanto, ci sono tre orbitali: gli 1Due, i 2sDue e il 2pDue, ciascuno con due elettroni. Questo può essere visto anche nell'immagine sopra: tre anelli con due elettroni (stelle blu) ciascuno (non confondere gli anelli per orbite: sono orbitali).
Si noti, tuttavia, che due delle stelle hanno una tonalità di blu più scura rispetto alle restanti quattro. Perché? Perché i primi due corrispondono allo strato interno 1Due o [He], che non partecipa direttamente alla formazione di legami chimici; mentre gli elettroni del guscio esterno, 2s e 2p, lo fanno.
Gli orbitali se p non hanno la stessa forma, quindi l'atomo illustrato non è d'accordo con la realtà; oltre alla grande sproporzione della distanza tra gli elettroni e il nucleo, che dovrebbe essere centinaia di volte maggiore.
Pertanto, la struttura dell'atomo di carbonio è costituita da tre orbitali in cui gli elettroni "si fondono" in nuvole elettroniche sfocate. E tra il nucleo e questi elettroni c'è una distanza che rivela l'immenso "vuoto" all'interno dell'atomo..
Ibridazione
È stato accennato in precedenza che l'atomo di carbonio è tetravalente. Secondo la sua configurazione elettronica, i suoi elettroni 2s sono accoppiati e gli elettroni 2p non accoppiati:
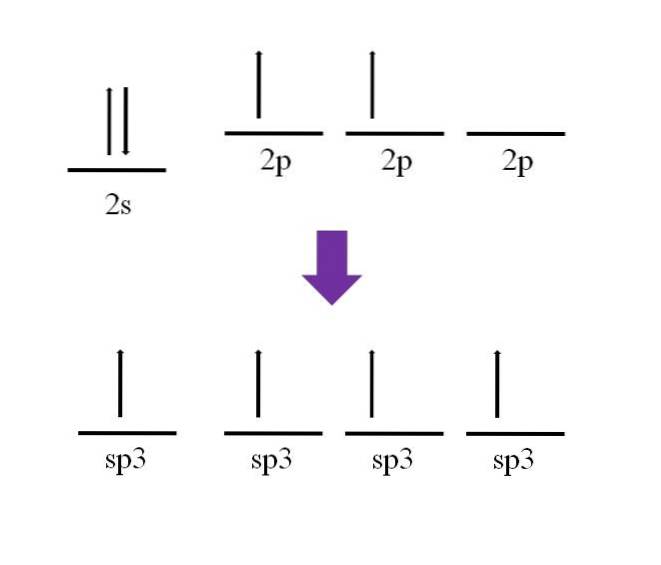
È disponibile un orbitale p, che è vuoto e riempito con un elettrone aggiuntivo sull'atomo di azoto (2p3).
Secondo la definizione del legame covalente, è necessario che ogni atomo contribuisca con un elettrone alla sua formazione; tuttavia, si può vedere che in stato di base dell'atomo di carbonio, ha solo due elettroni spaiati (uno in ogni orbitale 2p). Ciò significa che in questo stato è un atomo bivalente e quindi forma solo due legami (-C-).
Allora come è possibile che l'atomo di carbonio formi quattro legami? Per fare ciò, è necessario promuovere un elettrone dall'orbitale 2s all'orbitale 2p di maggiore energia. Fatto ciò, i quattro orbitali risultanti sono degenerare; in altre parole, hanno la stessa energia o stabilità (nota che sono allineati).
Questo processo è noto come ibridazione e, grazie ad esso, l'atomo di carbonio ha ora quattro orbitali sp3 con un elettrone ciascuno per formare quattro legami. Ciò è dovuto alla sua caratteristica di essere tetravalente.
sp3
Quando l'atomo di carbonio ha un'ibridazione sp3, orienta i suoi quattro orbitali ibridi ai vertici di un tetraedro, che è la sua geometria elettronica.
Quindi, si può identificare una specie di carbonio3 perché forma solo quattro legami semplici, come nella molecola di metano (CH4). E intorno ad esso si può osservare un ambiente tetraedrico.
La sovrapposizione degli orbitali sp3 è così efficace e stabile che il singolo legame C-C ha un'entalpia di 345,6 kJ / mol. Questo spiega perché ci sono infinite strutture di carbonato e un numero incommensurabile di composti organici. Oltre a questo, gli atomi di carbonio possono formare altri tipi di legami.
spDue e sp
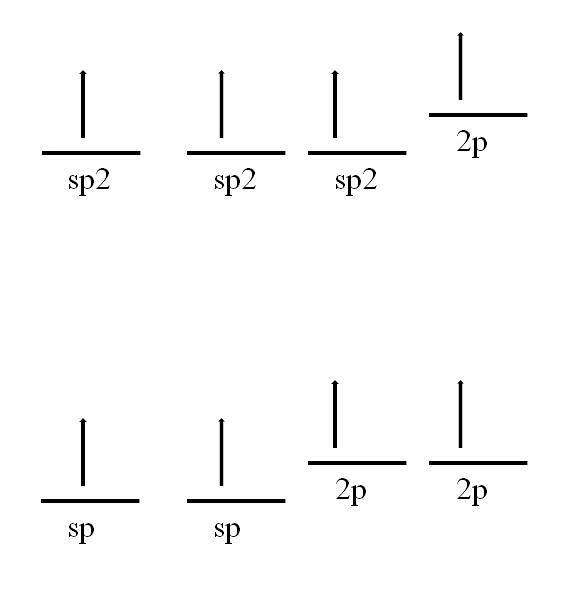
L'atomo di carbonio è anche in grado di adottare altre ibridazioni, che gli consentiranno di formare un doppio o addirittura triplo legame.
In sp ibridazioneDue, come si vede nell'immagine, ci sono tre orbitali spDue degenerare e un orbitale 2p rimane invariato o "puro". Con i tre orbitali spDue A 120 ° di distanza, il carbonio forma tre legami covalenti disegnando una geometria elettronica del piano trigonale; mentre con l'orbitale 2p, perpendicolare agli altri tre, forma un legame π: -C = C-.
Nel caso dell'ibridazione sp, ci sono due orbitali sp separati di 180º, in modo tale da disegnare una geometria elettronica lineare. Questa volta, hanno due orbitali 2p puri, perpendicolari tra loro, che consentono al carbonio di formare tripli legami o due doppi legami: -C≡C- o ·· C = C = C ·· (il carbonio centrale ha ibridazione sp ).
Si noti che sempre (generalmente) se si aggiungono i legami attorno al carbonio si troverà che il numero è uguale a quattro. Questa informazione è essenziale quando si disegnano strutture di Lewis o strutture molecolari. Un atomo di carbonio che forma cinque legami (= C≡C) è teoricamente e sperimentalmente inammissibile.
Classificazione
Come vengono classificati gli atomi di carbonio? Più che una classificazione per caratteristiche interne, in realtà dipende dall'ambiente molecolare. Cioè, all'interno di una molecola i suoi atomi di carbonio possono essere classificati in base a quanto segue.
Primario
Un carbonio primario è quello che è legato solo a un altro carbonio. Ad esempio, la molecola di etano, CH3-CH3 Consiste di due carboni primari legati. Questo segnala la fine o l'inizio di una catena di carbonio.
Secondario
È uno che è collegato a due atomi di carbonio. Quindi, per la molecola di propano, CH3-CHDue-CH3, l'atomo di carbonio medio è secondario (il gruppo metilene, -CHDue-).
Terziario
I carboni terziari differiscono dagli altri perché da essi emergono rami della catena principale. Ad esempio, 2-metilbutano (chiamato anche isopentano), CH3-CH(CH3) -CHDue-CH3 ha un carbonio terziario evidenziato in grassetto.
Quaternario
E infine, i carboni quaternari, come suggerisce il nome, sono collegati ad altri quattro atomi di carbonio. La molecola di neopentano, C(CH3)4 possiede un atomo di carbonio quaternario.
Applicazioni
Unità di massa atomica
La massa atomica media di 12C è utilizzato come misura standard per il calcolo delle masse degli altri elementi. Pertanto, l'idrogeno pesa un dodicesimo di questo isotopo del carbonio, che viene utilizzato per definire ciò che è noto come unità di massa atomica u.
Pertanto, le altre masse atomiche possono essere confrontate con quella di 12C e il 1H. Ad esempio, il magnesio (24Mg) pesa circa il doppio del peso di un atomo di carbonio e 24 volte di più di un atomo di idrogeno.
Ciclo e vita del carbonio
Le piante assorbono CODue nel processo di fotosintesi per rilasciare ossigeno nell'atmosfera e agire come polmoni delle piante. Quando muoiono, si trasformano in carbone, che dopo essere bruciato rilascia nuovamente CODue. Una parte ritorna alle piante, ma un'altra finisce nei fondali marini, nutrendo molti microrganismi.
Quando i microrganismi muoiono, il solido che rimane nella sua decomposizione biologica si sedimenta e, dopo milioni di anni, si trasforma in quello che è noto come olio..
Quando l'umanità utilizza questo petrolio come fonte di energia alternativa alla combustione del carbone, contribuisce al rilascio di più CODue (e altri gas indesiderati).
D'altra parte, la vita usa atomi di carbonio dal profondo. Ciò è dovuto alla stabilità dei suoi legami, che gli consente di formare catene e strutture molecolari che compongono macromolecole importanti quanto il DNA..
Spettroscopia NMR 13C
Il 13C, sebbene sia in una proporzione molto inferiore a quella di 12C, la sua abbondanza è sufficiente per chiarire le strutture molecolari mediante la spettroscopia di risonanza magnetica nucleare al carbonio 13.
Grazie a questa tecnica di analisi è possibile determinare quali atomi circondano il 13C ea quali gruppi funzionali appartengono. Pertanto, è possibile determinare lo scheletro di carbonio di qualsiasi composto organico..
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. Chimica organica. Ammine. (10a edizione.) Wiley Plus.
- Blake D. (4 maggio 2018). Quattro caratteristiche del carbonio. Estratto da: sciencing.com
- Royal Society of Chemistry. (2018). Carbone. Tratto da: rsc.org
- Capire l'evoluzione. (s.f.). Viaggio di un atomo di carbonio. Estratto da: evolution.berkeley.edu
- Encyclopædia Britannica. (14 marzo 2018). Carbone. Estratto da: britannica.com
- Pappas S. (29 settembre 2017). Fatti sul carbonio. Estratto da: livescience.com



Nessun utente ha ancora commentato questo articolo.