
Caratteristiche ed esempi di soluzioni concentrate

UN soluzione concentrata È uno che contiene una grande quantità di soluto in relazione alla quantità che potrebbe dissolversi; mentre una soluzione diluita ha una bassa concentrazione di soluto. Una soluzione diluita può essere preparata da una soluzione concentrata aggiungendovi del solvente o, se possibile, estraendone il soluto..
Il concetto può essere relativo, poiché ciò che definisce una soluzione concentrata sono valori elevati in alcune delle sue proprietà; ad esempio, una meringa gelato ha un'alta concentrazione di zucchero, che è dimostrata dal suo sapore dolce.
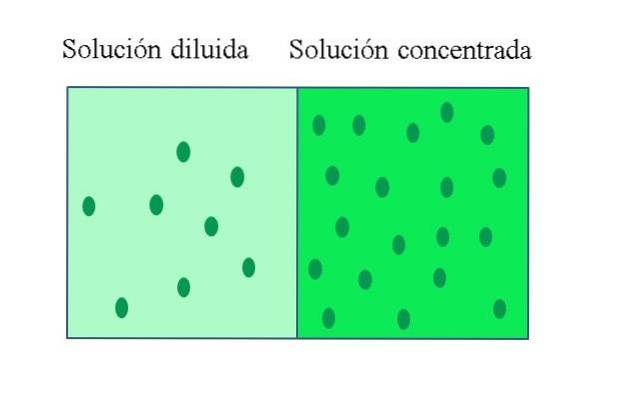
La concentrazione di soluto di una soluzione concentrata è vicina o uguale a quella di una soluzione satura. La caratteristica principale di una soluzione satura è che non può solubilizzare una quantità aggiuntiva di soluto a una certa temperatura. Pertanto, la concentrazione del soluto nelle sue soluzioni sature rimane costante..
La solubilità della maggior parte dei soluti aumenta con l'aumentare della temperatura. In questo modo una quantità aggiuntiva di soluto può essere solubilizzata in una soluzione satura..
Quindi, quando la temperatura diminuisce, la concentrazione di soluto della soluzione satura aumenta. Parlando in questo caso di una soluzione sovrasatura.
Indice articolo
- 1 Caratteristica di una soluzione concentrata
- 2 Proprietà colligative delle soluzioni
- 2.1 Osmolarità e osmolalità
- 2.2 Riduzione della pressione del vapore
- 2.3 Discesa del punto crioscopico
- 2.4 Elevazione del punto di ebollizione
- 2.5 Pressione osmotica
- 3 Differenze con la soluzione diluita
- 4 Esempi di soluzioni
- 4.1 Concentrato
- 4.2 Diluito
- 5 Riferimenti
Caratteristica di una soluzione concentrata
La concentrazione di una soluzione, ovvero la relazione tra la quantità di un soluto e la quantità di una soluzione o solvente, può essere espressa come percentuale di soluto nella soluzione (P / V o P / P).
Può anche essere espresso in moli di soluto per litro di soluzione (molarità) ed equivalenti di soluto per litro di soluzione (normalità).
Allo stesso modo, è comune esprimere la concentrazione di una soluzione in moli di soluto per chilogrammo di solvente (molalità) o esprimerla in moli di un soluto in relazione alle moli totali della soluzione (frazione molare). Nelle soluzioni diluite è comune trovare la concentrazione di una soluzione in p.p.m. (parti per milione).
Qualunque sia la forma di espressione della concentrazione di una soluzione, una soluzione concentrata ha un'elevata proporzione del soluto, in questo caso espressa come massa, in relazione alla massa o al volume della soluzione o del solvente. Questa concentrazione è uguale alla solubilità del soluto nel solvente o molto vicina al suo valore..
Proprietà colligative delle soluzioni
Sono un insieme di proprietà delle soluzioni che dipendono dal numero di particelle nella soluzione indipendentemente dal loro tipo.
Le proprietà colligative non discriminano tra le caratteristiche delle particelle, siano esse atomi di sodio, cloro, glucosio, ecc. L'importante è il tuo numero.
A causa di questo fatto, è diventato necessario creare un modo diverso per esprimere la concentrazione di una soluzione che è correlata alle cosiddette proprietà colligative. In risposta a ciò, sono state create le espressioni osmolarità e osmolalità.
Osmolarità e osmolalità
L'osmolarità è correlata alla molarità della soluzione e l'osmolalità alla sua molalità..
Le unità di osmolarità sono osm / L di soluzione o mosm / L di soluzione. Mentre le unità di osmolalità sono osm / kg di acqua o mosm / kg di acqua.
Osmolarità = mvg
m = molarità della soluzione.
v = numero di particelle in cui un composto si dissocia in soluzione acquosa. Ad esempio: per NaCl, v ha un valore di 2; per CaClDue, v ha un valore di 3 e per il glucosio, un composto elettrolitico che non si dissocia, v ha un valore di 1.
g = coefficiente osmotico, fattore di correzione per l'interazione di particelle cariche elettricamente in soluzione. Questo fattore di correzione ha un valore vicino a 1 per le soluzioni diluite e tende a zero all'aumentare della molarità del composto elettrolitico..
Di seguito vengono menzionate le proprietà colligative, che consentono di determinare la quantità di concentrazione di una soluzione.
Riduzione della pressione del vapore
Quando l'acqua viene riscaldata evapora e il vapore formatosi esercita una pressione. Man mano che viene aggiunto il soluto, la pressione del vapore diminuisce.
Pertanto, le soluzioni concentrate hanno una bassa pressione di vapore. La spiegazione è che le molecole di soluto spostano le molecole d'acqua all'interfaccia acqua-aria..
Discesa crioscopica del punto
All'aumentare dell'osmolarità di una soluzione, la temperatura alla quale la soluzione acquosa si congela diminuisce. Se la temperatura di congelamento dell'acqua pura è 0 ° C, la temperatura di congelamento di una soluzione acquosa concentrata diventa inferiore a quel valore..
Elevazione del punto di ebollizione
Secondo la legge di Raoult, l'elevazione del punto di ebollizione del solvente puro è direttamente proporzionale alla molarità della soluzione che si origina dall'aggiunta di soluto. Pertanto, le soluzioni concentrate hanno un punto di ebollizione più alto dell'acqua..
Pressione osmotica
Sono presenti due scomparti con concentrazioni differenti, separati da una membrana che permette il passaggio dell'acqua, ma limita il passaggio delle particelle di soluto..
L'acqua fluirà dalla soluzione con la più bassa concentrazione di soluto alla soluzione con la più alta concentrazione di soluto.
Questo flusso netto di acqua scomparirà gradualmente poiché l'acqua accumulata nel compartimento con la concentrazione più alta genera una pressione idrostatica che si oppone al flusso dell'acqua in questo compartimento..
Il flusso dell'acqua per osmosi avviene generalmente verso soluzioni concentrate.
Differenze con la soluzione diluita
-Le soluzioni concentrate hanno un'elevata proporzione di soluto in relazione al volume o alla massa della soluzione. Le soluzioni diluite hanno una bassa proporzione di soluto in relazione al volume o alla massa della soluzione.
-Hanno una molarità, molalità e normalità superiori a quelle delle soluzioni diluite.
-Il punto di congelamento delle soluzioni concentrate è inferiore a quello delle soluzioni diluite; cioè si congelano a temperature più fredde.
-Una soluzione concentrata ha una pressione di vapore inferiore rispetto a una soluzione diluita.
-Le soluzioni concentrate hanno un punto di ebollizione più elevato rispetto alle soluzioni diluite.
-Messa a contatto attraverso una membrana semipermeabile, l'acqua scorrerà dalle soluzioni diluite alle soluzioni concentrate.
Esempi di soluzioni
Concentrato
-Il miele è una soluzione satura di zucchero. È comune osservare il verificarsi della ricristallizzazione dello zucchero, evidenziata nei coperchi dei contenitori che contengono il miele.
-Acqua di mare che ha un'alta concentrazione di vari sali.
-Urina di persone con grave disidratazione.
-L'acqua gassata è una soluzione satura di anidride carbonica.
Diluito
-Urina di una persona con un'eccessiva assunzione di acqua.
-Il sudore è solitamente di bassa osmolarità.
-Molti farmaci somministrati in soluzione hanno una bassa concentrazione.
Riferimenti
- Wikipedia. (2018). Concentrazione. Estratto da: es.wikipedia.org
- Falst L. (2018). Concentrazione delle soluzioni: definizione e livelli. Studia. Estratto da: study.com
- The Chemistry Companion for Middle School Teachers- Sample. (s.f.). Soluzioni e concentrazione. [PDF]. Estratto da: ice.chem.wisc.edu
- Soluzioni acquose - Molarità. Estratto da: chem.ucla.edu
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.



Nessun utente ha ancora commentato questo articolo.