
Tipi di legami chimici

I legami chimici sono i forze che tengono insieme gli atomi per formare le molecole. Esistono tre tipi di legami tra gli atomi:
- Legame metallico.
- Legame ionico.
- Legame covalente: non polare, polare, singolo, doppio, triplo, dativo.
Grazie a questi legami si formano tutti i composti che esistono in natura. Esistono anche forze che tengono insieme le molecole, note come legami intermolecolari, come:
- Legami o legami idrogeno.
- Forze dipolo-dipolo.
Successivamente, spieghiamo ciascuno di questi collegamenti.
| Tipi di legame chimico | Caratteristica | Esempi | |
|---|---|---|---|
| Metallo | Gli ioni metallici galleggiano in un mare di elettroni in movimento. | Elementi metallici: sodio, bario, argento, ferro, rame. | |
| Ionico | Trasferimento di elettroni da un atomo all'altro. | Cloruro di sodio Na+Cl- | |
| Covalente | Non polare | Condividi gli elettroni equamente tra due atomi. | Idrogeno molecolare H-H o H.Due |
| Polare | Condividi gli elettroni in modo non uniforme tra due atomi. | Molecola d'acqua HDueO | |
| Semplice | Condividi un paio di elettroni. | Molecola di cloro ClDue Cl-Cl | |
| Doppio | Condividi due coppie di elettroni. | Molecola di ossigeno ODue O = O | |
| Triplicare | Condividi tre coppie di elettroni. | Molecola di azoto N≣N o NDue | |
| Dativo | Solo uno degli atomi condivide gli elettroni. | Legame tra azoto e boro nel composto trifluoruro di boro-ammoniaca. | |
| Forze intermolecolari | Ponte dell'idrogeno | Gli idrogeni di una molecola sono attratti dagli atomi elettronegativi di un'altra molecola. | L'idrogeno si lega tra l'idrogeno di una molecola d'acqua con l'ossigeno di un'altra molecola d'acqua. |
| Dipolo-dipolo | Le molecole con due poli elettrici attraggono i poli opposti di altre molecole. | Interazioni tra molecole H metanicheDueC = O | |
Legame metallico
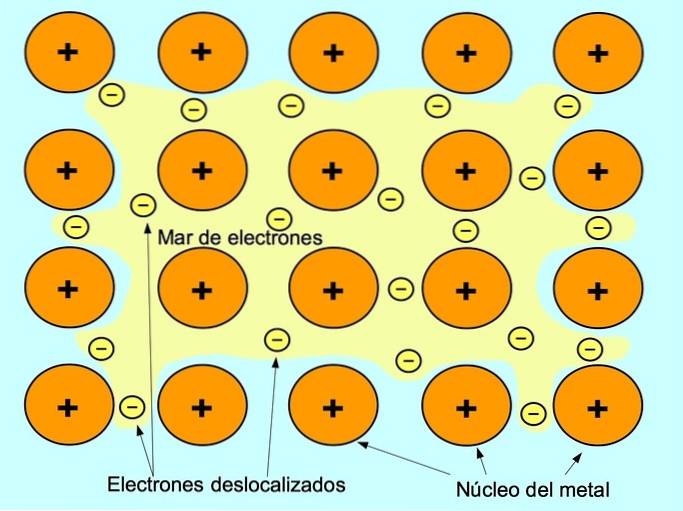
Il legame metallico è la forza di attrazione tra gli ioni positivi degli elementi metallici e gli elettroni negativi che si muovono liberamente tra gli ioni. Gli atomi di metallo sono strettamente imballati, questo consente agli elettroni di muoversi all'interno del reticolo degli atomi.
Nei metalli, gli elettroni di valenza vengono rilasciati dal loro atomo originale e formano un "mare" di elettroni che galleggia attorno all'intera struttura metallica. Ciò fa sì che gli atomi di metallo si trasformino in ioni metallici caricati positivamente che si impacchettano insieme..
Il legame metallico è stabilito tra elementi metallici come sodio Na, bario Ba, calcio Ca, magnesio Mg, oro Au, argento Ag e alluminio Al.
Legame ionico
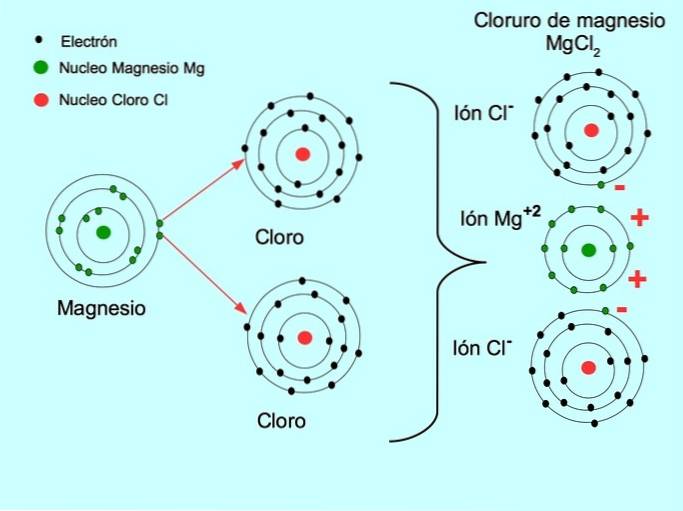
Il legame ionico è la forza che unisce un elemento metallico, come il sodio o il magnesio, con un elemento non metallico, come il cloro o lo zolfo. Il metallo perde elettroni e si trasforma in uno ione metallico positivo chiamato catione. Questi elettroni passano all'elemento non metallico e si trasforma in uno ione caricato negativamente chiamato anione.
I cationi e gli anioni si combinano e formano una rete tridimensionale che viene mantenuta dalle forze di attrazione elettrostatica tra gli ioni con cariche diverse. Queste forze formano composti ionici.
La crosta terrestre è costituita principalmente da composti ionici. La maggior parte delle rocce, dei minerali e delle pietre preziose sono composti ionici. Per esempio:
- Cloruro di sodio NaCl: l'elemento metallico è il sodio che trasferisce un elettrone al cloro, che è l'elemento non metallico.
- Cloruro di magnesio MgClDue: Il magnesio Mg dona due elettroni a due atomi di cloro, come mostrato nella figura seguente:
Vedi anche Differenza tra cationi e anioni.
Legame covalente
Il legame covalente si forma quando due atomi non metallici condividono gli elettroni. Questo legame può essere di diversi tipi a seconda dell'affinità per gli elettroni degli atomi e della quantità di elettroni condivisi.
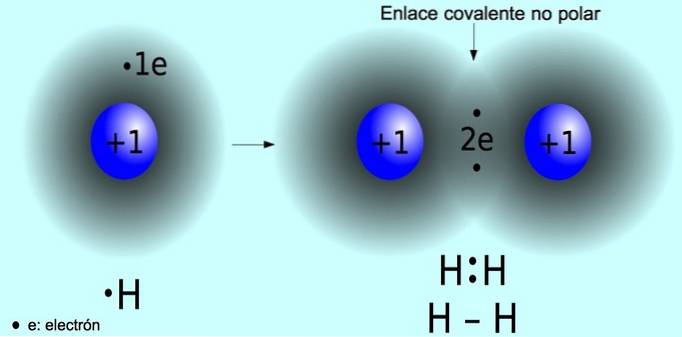
Legame covalente non polare
Il legame covalente non polare è il legame che si forma tra due atomi in cui gli elettroni sono condivisi equamente. Questo legame si verifica normalmente in molecole simmetriche, cioè molecole composte da due atomi uguali, come la molecola di idrogeno HDue e la molecola di ossigeno ODue.
Legame covalente polare
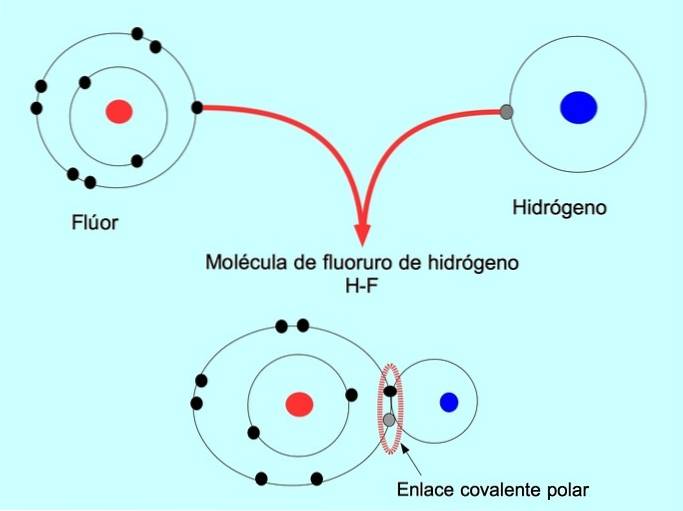
Il legame covalente polare si forma quando due atomi condividono gli elettroni ma uno di loro ha una maggiore attrazione per gli elettroni. Questo fa sì che la molecola abbia un "polo" più negativo con un numero maggiore di elettroni e il polo opposto è più positivo..
Le molecole con questa distribuzione o squilibrio di elettroni sono note come polari. Ad esempio, nell'idrogeno fluoruro HF, c'è un legame covalente tra idrogeno e fluoro, ma il fluoro ha un'elettronegatività più elevata, quindi attrae più fortemente gli elettroni condivisi..
Legame covalente semplice
Quando due atomi condividono due elettroni, uno da ciascuno, il legame covalente formato è chiamato legame covalente semplice.
Ad esempio, il cloro è un atomo che ha sette elettroni di valenza nel suo guscio esterno, che può essere riempito con otto elettroni. Un cloro può combinarsi con un altro cloro per formare la molecola di cloro ClDue che è molto più stabile del solo cloro.
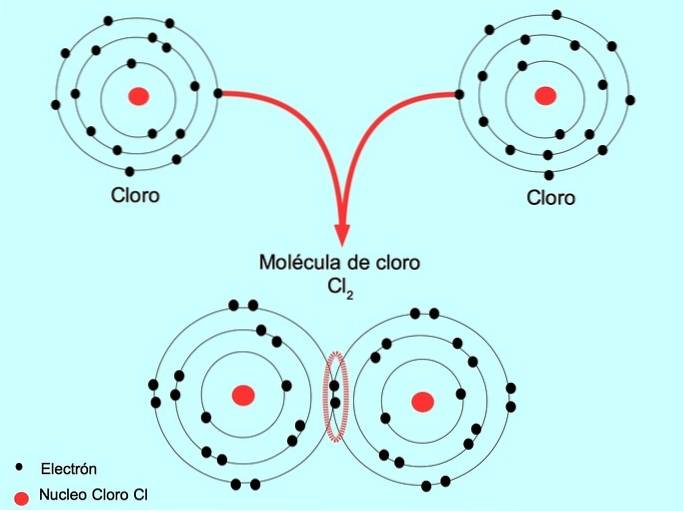
Doppio legame covalente
Il doppio legame covalente è il legame in cui quattro elettroni (due coppie) di elettroni sono condivisi tra due atomi. Ad esempio, l'ossigeno ha 6 elettroni nel suo ultimo guscio. Quando due ossigeni vengono combinati, quattro elettroni vengono condivisi tra i due, facendo sì che ciascuno abbia 8 elettroni nell'ultimo guscio..
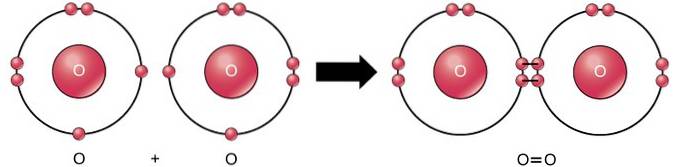
Triplo legame covalente
Il triplo legame covalente si forma quando 6 elettroni (o tre coppie) sono condivisi tra due atomi. Ad esempio, nella molecola di acido cianidrico HCN, si forma un triplo legame tra carbonio e azoto, come mostrato nella figura seguente:
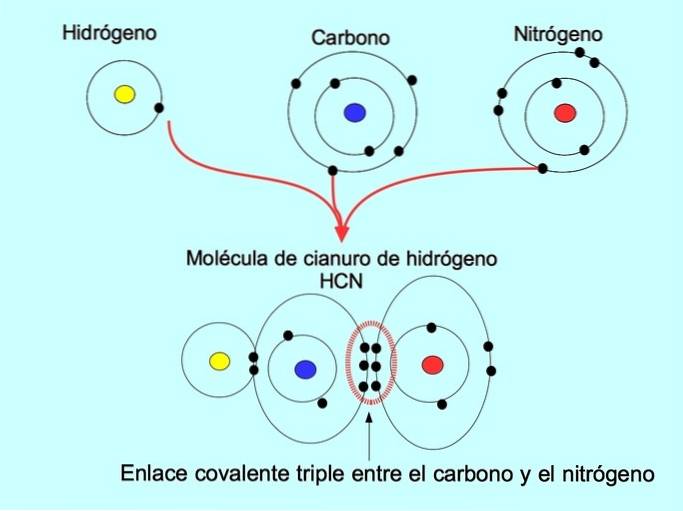
Legame covalente coordinato o dativo
Il legame covalente coordinato o dativo è il legame che si forma quando solo uno degli atomi nel legame contribuisce con una coppia di elettroni. Ad esempio, quando l'ammoniaca NH reagisce3 con trifluoruro di boro BF3, L'azoto si lega con due elettroni direttamente al boro, che non ha elettroni disponibili da condividere. In questo modo, sia l'azoto che il boro vengono lasciati con 8 elettroni nel loro guscio di valenza..
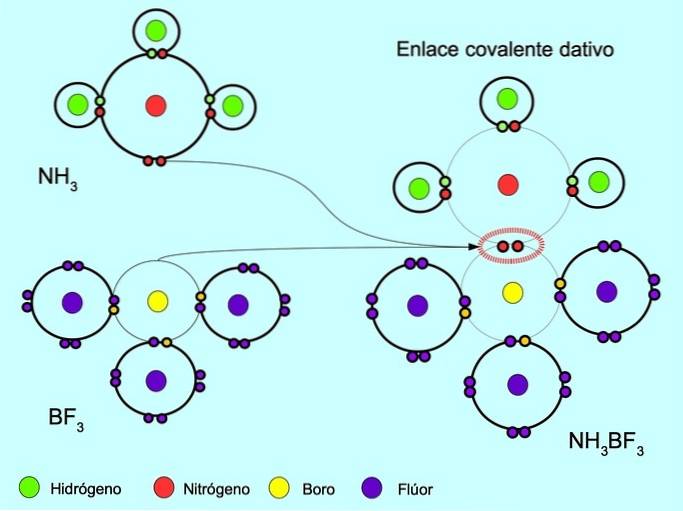
Vedi anche Composti organici e inorganici.
Collegamenti intermolecolari
Le molecole si associano tramite forze che consentono di formare sostanze allo stato liquido o solido.
Legami o forze dipolo-dipolo
Deboli legami intermolecolari possono essere stabiliti tra molecole polari quando i poli negativi sono attratti dai poli positivi e viceversa. Ad esempio, methanal HDueC = O è una molecola polare, con una parziale carica negativa sull'ossigeno e una parziale carica positiva sugli idrogeni. Il lato positivo di una molecola metanale attrae il lato negativo di un'altra molecola metanale.
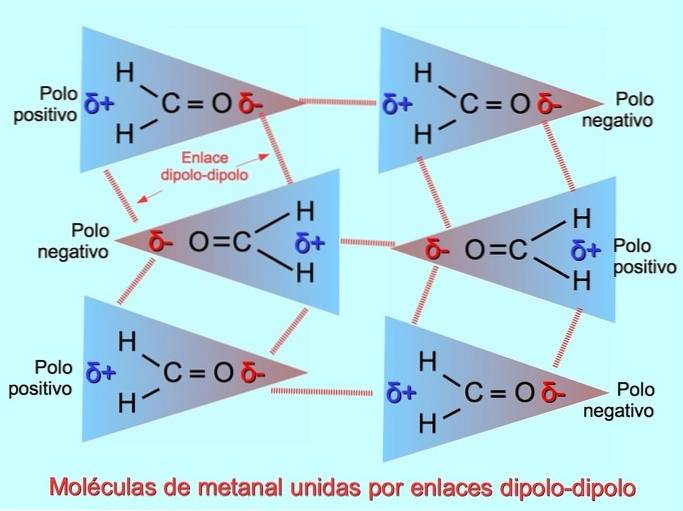
Legami o legami idrogeno
Il legame idrogeno o legame idrogeno è un legame che si stabilisce tra le molecole. Si verifica quando un idrogeno nella molecola è legato in modo covalente a un ossigeno, un azoto o un fluoro. Ossigeno, azoto e fluoro sono atomi con una maggiore elettronegatività, quindi attraggono più fortemente gli elettroni quando li condividono con un altro atomo meno elettronegativo..
Esistono legami idrogeno tra le molecole d'acqua HDueO e NH ammoniaca3 come mostra l'immagine:
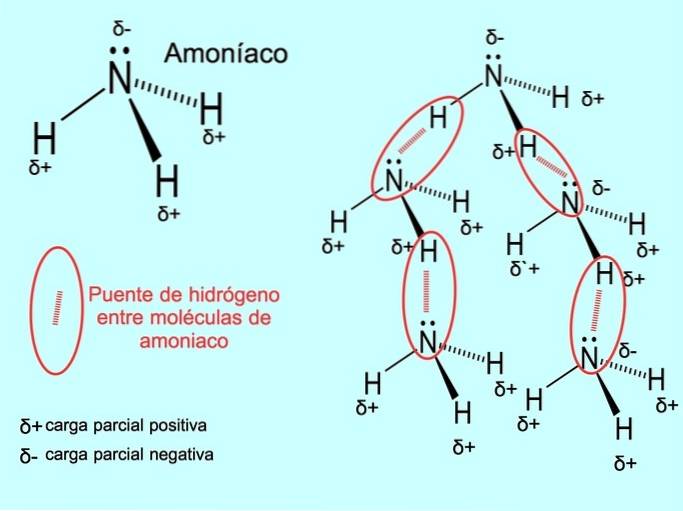
Potresti essere interessato a vedere:
- Atomi e molecole.
- Esempi di composti organici e inorganici.
Riferimenti
Zumdahl, S.S., Zumdahl, S.A. (2014) Chimica. Nona edizione. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5a edizione. Pearson Australia. Melbourne.



Nessun utente ha ancora commentato questo articolo.