
Calorimetria cosa studia e applicazioni
Il calorimetria è una tecnica che determina le variazioni del contenuto calorico di un sistema associato a un processo chimico o fisico. Si basa sulla misurazione delle variazioni di temperatura quando un sistema assorbe o emette calore. Il calorimetro è l'apparecchiatura utilizzata nelle reazioni in cui è coinvolto uno scambio termico.
Ciò che è noto come "tazza da caffè" è la forma più semplice di questo tipo di apparecchio. Attraverso il suo utilizzo si misura la quantità di calore coinvolta nelle reazioni condotte a pressione costante in una soluzione acquosa. Il calorimetro di una tazzina da caffè è costituito da un contenitore di polistirolo, che viene posto in un becher..

L'acqua viene posta nel contenitore in polistirolo, dotato di un coperchio dello stesso materiale che le conferisce un certo grado di isolamento termico. Inoltre, il contenitore ha un termometro e un agitatore meccanico..
Questo calorimetro misura la quantità di calore che viene assorbita o emessa, a seconda che la reazione sia endotermica o esotermica, quando una reazione avviene in una soluzione acquosa. Il sistema da studiare è costituito dai reagenti e dai prodotti.
Indice articolo
- 1 Cosa studia la calorimetria?
- 2 Capacità termica di un calorimetro
- 2.1 Esempio di utilizzo del calorimetro per calcolare il calore specifico
- 3 Pompa calorimetrica
- 4 tipi di calorimetro
- 4.1 Calorimetro isotermico di titolazione (CTI)
- 4.2 Calorimetro a scansione differenziale
- 5 Applicazioni
- 5.1 Usi della calorimetria di titolazione isotermica
- 5.2 Usi della calorimetria a scansione differenziale
- 6 Riferimenti
Cosa studia la calorimetria?
La calorimetria studia la relazione tra l'energia termica associata a una reazione chimica e come viene utilizzata per determinarne le variabili. Le loro applicazioni nei campi di ricerca giustificano la portata di questi metodi.
Capacità calorica di un calorimetro
Questa capacità viene calcolata dividendo la quantità di calore assorbito dal calorimetro per la variazione di temperatura. Questa variazione è il prodotto del calore emesso in una reazione esotermica, che è pari a:
Quantità di calore assorbita dal calorimetro + quantità di calore assorbita dalla soluzione
La variazione può essere determinata aggiungendo una quantità nota di calore misurando la variazione di temperatura. Per questa determinazione della capacità calorica viene solitamente utilizzato l'acido benzoico, poiché il suo calore di combustione è noto (3.227 kJ / mol).
La capacità calorica può essere determinata anche aggiungendo calore per mezzo di una corrente elettrica.
Esempio di usare il calorimetro per calcolare il calore specifico
Una barra da 95 g di un metallo viene riscaldata a 400ºC, portandola immediatamente ad un calorimetro con 500 g di acqua, inizialmente a 20ºC. La temperatura finale del sistema è di 24 ºC. Calcola il calore specifico del metallo.
Δq = m x ce x Δt
In questa espressione:
Δq = variazione del carico.
m = massa.
ce = calore specifico.
Δt = variazione di temperatura.
Il calore guadagnato dall'acqua è uguale al calore sprigionato dalla barra metallica.
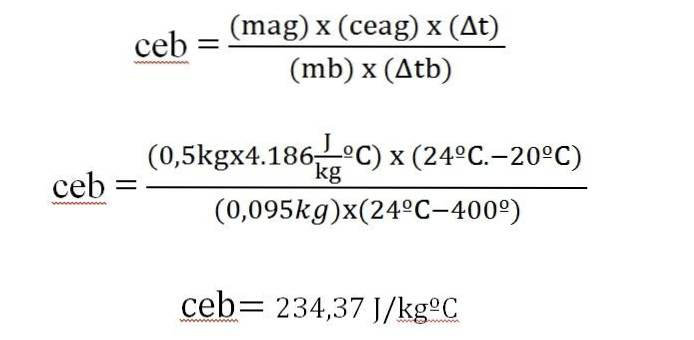
Questo valore è simile a quello che appare in una tabella del calore specifico per l'argento (234 J / kg ºC).
Quindi, una delle applicazioni della calorimetria è la cooperazione per l'identificazione dei materiali.
Pompa calorimetrica
È costituito da un contenitore in acciaio, noto come pompa, resistente alle alte pressioni che possono sorgere durante le reazioni che avvengono in questo contenitore; questo contenitore è collegato ad un circuito di accensione per avviare le reazioni.
La pompa è immersa in un capiente contenitore con acqua, la cui funzione è quella di assorbire il calore che si genera nella pompa durante le reazioni, riducendo al minimo la variazione di temperatura. Il contenitore dell'acqua è dotato di un termometro e di un agitatore meccanico.
Le variazioni di energia vengono misurate a un volume e una temperatura praticamente costanti, quindi non viene eseguito alcun lavoro sulle reazioni che si verificano nella pompa.
ΔE = q
ΔE è la variazione dell'energia interna nella reazione eq il calore generato in questa.
Tipi di calorimetro
Calorimetro di titolazione isotermica (CTI)
Il calorimetro ha due celle: in una viene posto il campione e nell'altra viene posto il riferimento, generalmente l'acqua.
La differenza di temperatura che si genera tra le celle - a causa della reazione che avviene nella cella campione - viene annullata da un sistema di feedback che inietta calore per equalizzare le temperature delle celle..
Questo tipo di calorimetro permette di seguire l'interazione tra macromolecole e loro ligandi..
Calorimetro a scansione differenziale
Questo calorimetro ha due celle, come il CTI, ma ha un dispositivo che permette di determinare la temperatura e i flussi di calore associati ai cambiamenti di un materiale in funzione del tempo.
Questa tecnica fornisce informazioni sul ripiegamento di proteine e acidi nucleici, nonché sulla loro stabilizzazione..
Applicazioni

-La calorimetria permette di determinare lo scambio termico che avviene in una reazione chimica, permettendo così una più chiara comprensione del meccanismo di questa.
-Determinando il calore specifico di un materiale, la calorimetria fornisce dati che aiutano a identificarlo.
-Poiché esiste una proporzionalità diretta tra la variazione di calore di una reazione e la concentrazione dei reagenti, unita al fatto che la calorimetria non richiede campioni chiari, questa tecnica può essere utilizzata per determinare la concentrazione di sostanze presenti in matrici complesse..
-Nel campo dell'ingegneria chimica, la calorimetria è utilizzata nel processo di sicurezza, così come in diversi campi del processo di ottimizzazione, reazione chimica e nell'unità operativa..
Usi della calorimetria di titolazione isotermica
-Collabora alla definizione del meccanismo di azione enzimatica, nonché alla sua cinetica. Questa tecnica può misurare le reazioni tra le molecole, determinando l'affinità di legame, la stechiometria, l'entalpia e l'entropia in soluzione senza la necessità di marcatori..
-Valuta l'interazione delle nanoparticelle con le proteine e, in combinazione con altri metodi analitici, è uno strumento importante per registrare i cambiamenti conformazionali nelle proteine.
-Ha applicazione nella conservazione del cibo e delle colture.
-Per quanto riguarda la conservazione degli alimenti, è possibile determinarne il deterioramento e la conservabilità (attività microbiologica). Può confrontare l'efficienza di diversi metodi di conservazione degli alimenti ed è in grado di determinare la dose ottimale di conservanti, nonché la degradazione nel controllo del confezionamento.
-Per quanto riguarda le colture orticole, puoi studiare la germinazione del seme. Essendo in acqua e in presenza di ossigeno, rilasciano calore misurabile con un calorimetro isotermico. Esaminare l'età e la conservazione impropria dei semi e studiarne il tasso di crescita a fronte di variazioni di temperatura, pH o diverse sostanze chimiche.
-Infine, puoi misurare l'attività biologica dei suoli. Inoltre, può rilevare malattie.
Usi della calorimetria a scansione differenziale
-Insieme alla calorimetria isotermica, ha permesso di studiare l'interazione delle proteine con i loro ligandi, l'interazione allosterica, il ripiegamento delle proteine e il meccanismo della loro stabilizzazione..
-Il calore rilasciato o assorbito durante un evento di legame molecolare può essere misurato direttamente.
-La calorimetria differenziale a scansione è uno strumento termodinamico per stabilire direttamente l'assorbimento di energia termica che avviene in un campione. Ciò consente di analizzare i fattori coinvolti nella stabilità della molecola proteica..
-Studia anche la termodinamica della transizione di ripiegamento degli acidi nucleici. La tecnica consente la determinazione della stabilità ossidativa dell'acido linoleico isolato e accoppiato ad altri lipidi.
-La tecnica trova applicazione nella quantificazione di nanosolidi per uso farmaceutico e nella caratterizzazione termica di trasportatori lipidici nanostrutturati..
Riferimenti
- Whitten, K., Davis, R., Peck, M. e Stanley, G. Chimica. (2008). 8a ed. Modifica apprendimento Cengage.
- Rehak, N. N. e Young, D. S. (1978). Prospettive applicazioni della calorimetria nel laboratorio clinico. Clin. Chem.24 (8): 1414-1419.
- Stossel, F. (1997). Applicazioni della calorimetria di reazione nell'ingegneria chimica. J. Therm. Anale. 49 (3): 1677-1688.
- Weber, P. C. e Salemme, F. R. (2003). Applicazioni dei metodi calorimetrici alla scoperta di farmaci e allo studio delle interazioni proteiche. Curr. Opin. Struct. Biol.13 (1): 115-121.
- Gill, P., Moghadem, T. e Ranjbar, B. (2010). Tecniche calorimetriche a scansione differenziale: applicazioni in Biologia e nanoscienze. J. Biol. Tech. 21 (4): 167-193.
- Omanovic-Miklicanin, E., Manfield, I. e Wilkins, T. (2017). Applicazioni della calorimetria di titolazione isotermica nella valutazione delle interazioni tra proteine e nanoparticelle. J. Therm. Anale. 127: 605-613.
- Consorzio del Community College per le credenziali di bioscienza. (7 luglio 2014). Calorimetro della tazzina da caffè. [Figura]. Estratto il 7 giugno 2018 da: commons.wikimedia.org



Nessun utente ha ancora commentato questo articolo.